

 $\stackrel{还原}{→}$
$\stackrel{还原}{→}$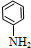 )
) (甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$
(甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$ $\stackrel{还原}{→}$丙$→_{④}^{F}$
$\stackrel{还原}{→}$丙$→_{④}^{F}$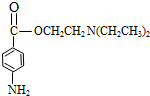 (普鲁卡因)
(普鲁卡因)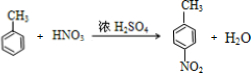 .反应③的化学方程式是(乙中有两种含氧官能团):
.反应③的化学方程式是(乙中有两种含氧官能团):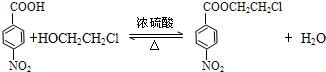 .
.分析 烃B是一种重要的有机化工原料,分子内C、H原子个数比为1:2,相对分子质量为28,应为CH2=CH2,可由乙醇或一氯乙烷发生消去反应生成,乙烯与HCl发生加成反应生成G应为CH3CH2Cl,由反应①可知D为 .
.
化合物E(HOCH2CH2Cl)和 F[HN(CH2CH3)2]是药品普鲁卡因合成的重要中间体,甲苯发生硝化反应生成甲为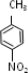 ,氧化生成的乙为
,氧化生成的乙为 ,对比
,对比 、
、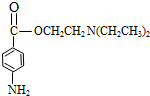 的结构可知丙为
的结构可知丙为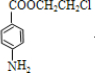 .
.
解答 解:烃B是一种重要的有机化工原料,分子内C、H原子个数比为1:2,相对分子质量为28,应为CH2=CH2,可由乙醇或一氯乙烷发生消去反应生成,乙烯与HCl发生加成反应生成G应为CH3CH2Cl,由反应①可知D为 .
.
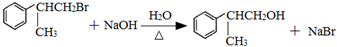
(1)B为CH2=CH2,可由乙醇或一氯乙烷发生消去反应生成,所以A可能为醇或氯代烃,故答案为:ab;
(2)由以上分析可知B为CH2=CH2,与HCl发生加成反应生成CH3CH2Cl,CH3CH2Cl与氨气发生取代反应,反应②的方程式为:2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl,
故答案为:CH2=CH2;加成反应;2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl;
(3)甲苯发生硝化反应生成甲为 ,方程式为
,方程式为 ,甲发生氧化反应生成乙为
,甲发生氧化反应生成乙为 ,反应③是乙与HOCH2CH2Cl发生取代反应,反应方程式为
,反应③是乙与HOCH2CH2Cl发生取代反应,反应方程式为 ,
,
故答案为: ;
; ;
;
(4)对比 、
、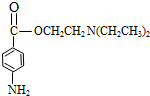 的结构可知丙为
的结构可知丙为 ,含有的官能团有酯基、氯原子、氨基,
,含有的官能团有酯基、氯原子、氨基,
故答案为:酯基、氯原子、氨基.
点评 本题考查有机物的推断与合成,充分利用有机物结构简式进行分析,侧重学生分析能力的考查,熟练掌握官能团的结构、性质与转化,难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 火碱能与酸反应,可用于治疗胃酸过多 | |
| B. | 晶体硅硬度大,可用于制作半导体材料 | |
| C. | SO2具有还原性,可用于漂白纸浆 | |
| D. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
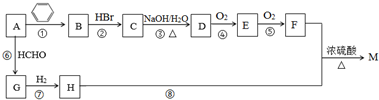
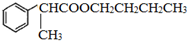 .B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为
.B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为 .
. .
. (任写一种物质的结构简式).
(任写一种物质的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
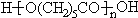 }及阻燃剂四溴双酚A.合成线路如图:
}及阻燃剂四溴双酚A.合成线路如图: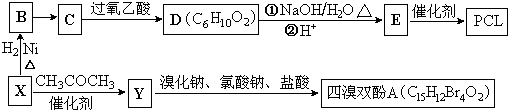
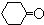
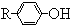 $\stackrel{溴化钠、氯化钠、盐酸}{→}$
$\stackrel{溴化钠、氯化钠、盐酸}{→}$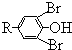
 .
. =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$ =CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
=CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料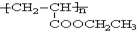 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: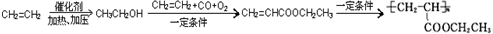 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
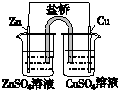 |  |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是:H++NO2-═HNO2, 2HNO2═NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol•L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol•L-1NH3•H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
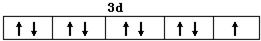 ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.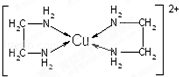 .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.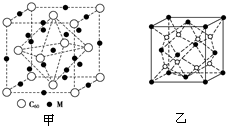
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

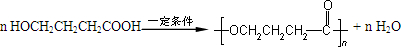 .
.
 .
.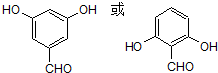 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:
物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题: ;第ⅦA族元素原子外围电子排布通式为ns2np5.
;第ⅦA族元素原子外围电子排布通式为ns2np5.| H | B | C | N | O | F |
| 2.18 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 |
| Si | P | S | Cl | ||
| 1.90 | 2.19 | 2.58 | 3.16 |
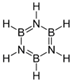 ,能发生加成反应、取代反应(填有机反应类型).
,能发生加成反应、取代反应(填有机反应类型).| 氨 | 三氟化氮 | |
VSEPR模 型 | 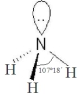 |  |
| 熔点/℃ | -77.7 | -206.8 |
| 沸点/℃ | -33.5 | -129.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com