
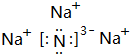 .
. 分析 ①电子层结构相同的离子,核电荷数越大离子半径越小;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠;
④Na3N属于离子化合物,由钠离子与氮离子构成.
解答 解:①电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(Na+)<r(N3-),
故答案为:<;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化,属于非氧化还原反应,
故答案为:非氧化还原;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠,
故答案为:NH4Cl、NaCl;
④Na3N属于离子化合物,由钠离子与氮离子构成,电子式为: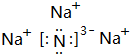 ,故答案为:
,故答案为: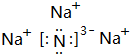 .
.
点评 本题考查微粒半径半径、氧化还原反应、电子式书写、信息获取与迁移运用等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
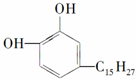 ②白藜芦醇
②白藜芦醇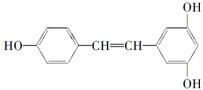
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实现现象 | 结论 |
| A | 向浓度均为0.1mol/L NaCl、KI混合液中逐滴加入AgNO3溶液 | 先出现黄色沉淀 | 溶解性:AgCl>AgI |
| B | 溴乙烷与NaOH的乙醇溶液共热,将逸出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
| C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中无NH4+ |
| D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y不可能位于同一周期 | |
| B. | X与Y不可能形成原子个数比为1:1型离子化合物 | |
| C. | X离子与Y离子的电子层结构可以相同 | |
| D. | X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
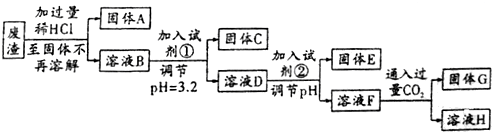
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
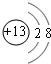 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com