
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素名称分别是:A___________,B___________,C___________,D___________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_______________。(用化学式表示,下同)
(3)A与B形成的三原子分子的电子式是___________,B与D形成的原子个数比为l∶l的化合物中含有的化学键类型有___________。
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是___________。
【答案】(1)碳氧硅钠
(2)H2O>CH4>SiH4
(3)![]() 离子键和共价键
离子键和共价键
(4) Na2SiO3+ CO2+ H2O= Na2CO3+ H2SiO3↓
【解析】试题分析:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为![]() ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,C最外层电子数为4,D的最外层电子数为1,A为C元素,C为Si元素,D为Na元素,据此解答该题。
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,C最外层电子数为4,D的最外层电子数为1,A为C元素,C为Si元素,D为Na元素,据此解答该题。
(1)根据上述推断,A、B、C、D元素的名称分别为碳、氧、硅、钠。
(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性O>C>Si,氢化物的稳定性为H2O>CH4>SiH4。
(3)A与B形成的三原子分子为CO2,其电子式是![]() ,B与D形成的原子个数比为1:1的化合物为过氧化钠,含有的化学键类型有离子键和共价键。
,B与D形成的原子个数比为1:1的化合物为过氧化钠,含有的化学键类型有离子键和共价键。
(4)根据上述推断,A和C分别为C、Si,非金属性越强,最高价含氧酸的酸性越强,若碳酸能和硅酸钠反应生成碳酸钠和硅酸(白色沉淀),则非金属性C>Si,化学方程式为Na2SiO3+ CO2+ H2O= Na2CO3+ H2SiO3↓。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的化学品。
(1)画出采用氨催化氧化法合成硝酸的反应原理流程图:(要求注明试剂、反应条件)
(示例:![]() )
)
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,是侯氏制碱法的关键步骤,用一个化学方程式表示该反应原理 。在0.1 mol/L的稀氨水中,下列式子成立的是 。
A.c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B.c(NH3·H2O) > c(NH3) + c(NH4+)
C.c(H+) > c(OH-)
D.c(NH4+) + c(H+) = c(OH-)
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为 ,物质B中所含的化学键类型有 。
(4)将6.4 g铜粉投入一定量的浓硝酸中,铜完全溶解,产生标准状况下的混合气体3.36 L,其中两种成分气体的体积比为 ,反应中总共消耗的硝酸 mol。
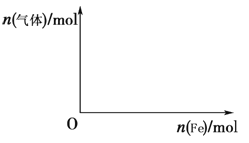
(5)向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设生成的气体只有一种,请在坐标系中画出n(气体)随n(Fe)变化的示意图,并标出n(气体)的最大值。
(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解饱和食盐水的装置如图所示(a、b为石墨电极,不考虑U形管中气体的溶解且a上产生的气体全部进入小试管中)。
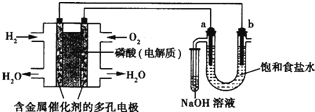
(1)写出通入H2这一极的电极反应_________,通入O2这一极的电极反应为_________。
(2)a为_________极,电极反应为_________ 。
(3)b为_________极,电极反应为_________。
(4)在25℃,当燃料电池中消耗 0.02g H2时,U形管中液体的体积为200mL(忽略实验过程中体积的变化), 求此时U形管中溶液的pH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质架构和性质的重要工具。请参照元素①—⑦在周期表中的位置,回答下列问题:

(1)元素⑦在元素周期表的位置为____________。
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式 。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为 。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
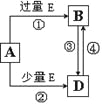
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组粒子互为同位素的是 (填编号,下同)。互为同素异形体的是 ,互为同分异构体的是 互为同系物的是 。
①16O2和18O3
②质子数相同而中子数不同的两种粒子
③11H、D、T
④3015R和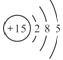 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖
⑥
⑦CH3CH2CH2CH2CH2CH3和(CH3)2CHCH(CH3)2
⑧(CH3)2CHCH(CH3)2和C(CH3)4
(2)生活中的一些问题常涉及化学知识,下列叙述正确的是(填序号) 。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
⑦为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
(3)在实验室生成乙酸乙酯的可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Ⅰ.按己知的原子结构规律,82号元素X应是第_________周期_________族元素,它的最高正价氧化物的化学式为_________。
Ⅱ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解。用序号填空:
(1)未破坏化学键的是_____________。
(2)仅离子键被破坏的是_____________。
(3)仅共价键被破坏的是_____________。
Ⅲ.有下列各组物质:①石墨和足球烯C60;②126C和136C;③CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3;④漂白粉和漂白液主要成分;⑤正丁烷和异庚烷;⑥乙烯和聚乙烯;⑦![]() 和
和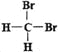 ;⑧丙烷和环丙烷。用序号填空:
;⑧丙烷和环丙烷。用序号填空:
(1)__________组两者互为同位素。(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2![]() Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。
Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。

(1)上述反应中的还原剂是__________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍。
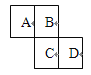
(1)写出A、B、C、D的元素符号:A 、B 、
C 、D 。
(2)A、B、C、D的气态氢化物最不稳定的是(写化学式) 。
(3)A、D两元素的气态氢化物相互反应的化学方程式为 ,现象为 ,产物为 化合物(填“离子”或“共价”)。该化合物中存在的化学键有 (填“离子键”或“共价键”)。
(4)写出下列电子式:
D的气态氢化物 ,A单质 。B的气态氢化物的形成过程用电子式表示: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com