
【题目】取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下).
(1)写出上述过程中发生的离子方程式 .
(2)计算原混合液体中,硫酸物质的量浓度是mol/L,盐酸物质的量浓度是mol/L(写出计算过程).
【答案】
(1)Ba2++SO42﹣=BaSO4↓、Fe+2H+=Fe2++H2↑
(2)1;2
【解析】解:(1)该过程中发生的反应有:钡离子与硫酸根离子生成硫酸钡沉淀:Ba2++SO42﹣=BaSO4↓,铁与氢离子反应生成氢气和亚铁离子:Fe+2H+=Fe2++H2↑,
所以答案是:Ba2++SO42﹣=BaSO4↓、Fe+2H+=Fe2++H2↑;(2)4.66g白色沉淀为硫酸钡,硫酸钡的物质的量与原溶液中硫酸的物质的量相等,则:n(H2SO4)=n(BaSO4)= ![]() =0.02mol,所以原溶液中硫酸的物质的量浓度为:c(H2SO4)=
=0.02mol,所以原溶液中硫酸的物质的量浓度为:c(H2SO4)= ![]() =1mol/L;
=1mol/L;
加入足量铁粉后生成的气体为氢气,标况下896mL氢气的物质的量为: ![]() =0.04mol,生成0.04mol氢气需要消耗0.08mol氢离子,则氢离子浓度为:
=0.04mol,生成0.04mol氢气需要消耗0.08mol氢离子,则氢离子浓度为: ![]() =4mol/L,其中1mol/L的硫酸中氢离子浓度为2mol/L,则c(HCl)=c(H+)盐酸电离的=4mol/L﹣1mol/L×2=2mol/L,
=4mol/L,其中1mol/L的硫酸中氢离子浓度为2mol/L,则c(HCl)=c(H+)盐酸电离的=4mol/L﹣1mol/L×2=2mol/L,
所以答案是:1;2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温常压下,amL三种气态烃以任意比混合后,和足量O2混合点燃,恢复到原状态后,测得气体体积共缩小2a mL(不考虑CO2的溶解).则三种烃可能的组合( )
A.C2H4、CH4、C3H4
B.CH4、C3H6、C2H2
C.C2H6、C3H6、C4H6
D.C3H8、C4H8、C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成: 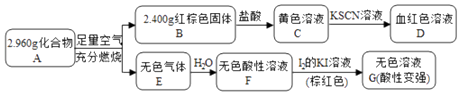
请回答:
(1)A的化学式为 . A煅烧生成B和E的化学方程式为 .
(2)溶液C可溶解铜片,反应的离子方程式为 , 例举该反应的一个实际应用是
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g/L),该气体分子的电子式为 . 该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
A. 2NaOH + H2SO4 = Na2SO4+2H2O
B. Ba(OH)2+2HCl = BaCl2+2H2O
C. Cu(OH)2+ 2HNO3=Cu(NO3)2+2H2O
D. KOH+ HCl = KCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,发生“先产生沉淀,然后沉淀又完全溶解”现象的是( )
A.向硫酸铝溶液中逐滴加入过量氨水
B.向硫酸铝溶液中逐滴加入过量氢氧化钡溶液
C.向硅酸钠溶液中逐滴加入过量稀盐酸
D.向氢氧化钡溶液中缓缓通入过量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3 , Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 , 该元素的符号是 .
(2)Y元素原子的价层电子的轨道表示式为 .
(3)X与Z可形成化合物XZ3 , 该化合物的空间构型为 .
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低 , 理由是 .
(5)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3 , 产物还有ZnSO4和H2O,该反应的化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com