
分析 (1)①根据燃烧热写出①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律,②×4-①来计算焓变;
②电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵;
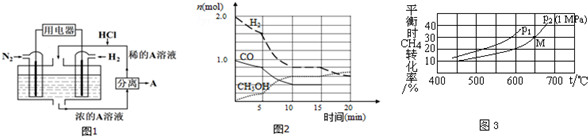
(2)①根据v=$\frac{△c}{△t}$结合图象计算CH3OH的速率,再根据速率之比等于系数之比计算CO的化学反应速率;根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$及各组分的浓度计算出该反应的平衡常数;
②反应速率加快,根据升温或者使用催化剂可以使反应速率加快分析;
(3)该反应为气体体积增大的反应,当温度一定时,根据甲烷的转化率与压强的关系可判断压强大小;p2时M点的甲烷的平衡转化率为30%,据此可计算得平衡是都只物质的浓度,再根平衡常数的定义进行计算.
解答 解:(1)①CH4、H2的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol;
则①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律,②×4-①得到:CO2 (g)+4H2(g)=CH4(g)+2H2O(l)△H=-285.8kJ•mol-1×4+890.3KJ/mol=-252.9 kJ/mol;
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9 kJ/mol;
②该电池的本质反应是合成氨反应,电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-=2NH4+,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①根据图象CH3OH的速率v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{10min}$=0.03mol/(L•min),又速率之比等于系数之比,所以CO的化学反应速率也为0.03mol/(L•min);又由图象可以看出平衡时氢气的物质的量为0.8mol,CO为0.4mol,CH3OH为0.6mol,所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$=$\frac{75}{8}$,
故答案为:0.03mol/(L•min);$\frac{75}{8}$;
②反应速率加快,而且在10分钟的时刻,达平衡状态,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
(3)该反应为气体体积增大的反应,当温度一定时,根据甲烷的转化率与压强的关系可判断压强大小知p1时的甲烷的转化率大于 p2 时的,即平衡向正反应方向移动,所以,p1<p2;p2时M点的甲烷的平衡转化率为30%,设起始CH4和H2O的物质的是量均为amol,
则根据反应,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始(mol) a a 0 0
转化(mol) 0.3a 0.3a 0.3a 0.9a
平衡(mol) 0.7a 0.7a 0.3a 0.9a
所以CH4、H2O、CO、H2平衡分压分别为$\frac{0.7a}{2.6a}$=$\frac{7}{26}$、$\frac{7}{26}$、$\frac{3}{26}$、$\frac{9}{26}$,则KP=$\frac{\frac{3}{26}×(\frac{9}{26})^{3}}{\frac{7}{26}×\frac{7}{26}}$=0.066,
故答案为:<; 0.066.
点评 本题考查盖斯定律的应用、原电池原理、平衡的移动和溶液中的反应等相关知识,综合性强,比较有难度.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里 | |
| B. | 称取胆矾50 g,溶解在1 L水里 | |
| C. | 将32 g胆矾溶于水,然后将此溶液稀释至1 L | |
| D. | 将50 g胆矾溶于水,然后将此溶液稀释至1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CH(OH)CH3 | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com