
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
分析 A.五氧化二磷与水反应生成酸,酸具有腐蚀性;
B.青蒿素为有机酯类物质,不溶于水,在超临界CO2中有很强的溶解性;
C.太阳能电池板发电,太阳能转化为电能,没有新物质生成;
D.核能、太阳能、氢能均为新能源.
解答 解:A.五氧化二磷与水反应生成酸,酸具有腐蚀性,不能作食品干燥剂,而硅胶可以,故A错误;
B.青蒿素为有机酯类物质,不溶于水,在超临界CO2中有很强的溶解性,则萃取青蒿素可用超临界CO2作萃取剂,故B正确;
C.太阳能电池板发电,太阳能转化为电能,没有新物质生成,则不发生化学变化,故C正确;
D.减少化石能源的使用,开发核能、太阳能、氢能等新能源,在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源,故D正确;
故选A.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、化学与生活、性质与用途等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
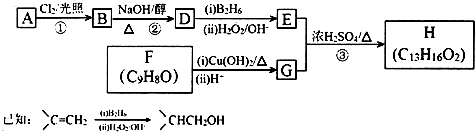

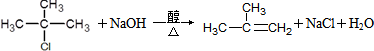 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
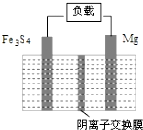 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
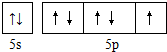 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有吸水性,可用于干燥CO2 | |
| C. | 铝具有高熔点,可用于生产耐火砖 | |
| D. | 硅有导电性,可用作光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com