
| A. | 所含质子数为(A-n) | B. | 所含中子数为(A-Z) | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z-n |
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
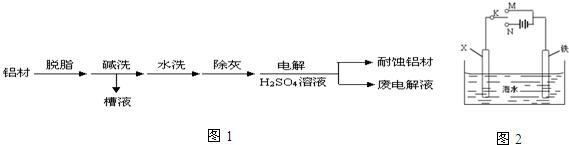
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:
BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
| 试验编号 | T/℃ | c起始(H2)/mol•L-1 | 重晶石的比表面积/m2•g-1 |
| Ⅰ | 850 | c1 | 3.4 |
| Ⅱ | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素电负性:Ti<Ga | |
| B. | 第二电离能(I2):Na>Mg | |
| C. | 金属晶体的晶胞中空间利用率:体心立方堆积>面心立方堆积. | |
| D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比水的密度小 | |
| B. | 氨气极易溶于水 | |
| C. | SbH3的沸点比PH3高 | |
| D. | 溶解度:邻羟基苯甲醛<对羟基苯甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | SiO2常用于制造光导纤维 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑧ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
| 4 | ② | ④ |
 ;元素⑥的气态氢化物分子式SiH4.
;元素⑥的气态氢化物分子式SiH4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①-⑤-②-①-④-③ | B. | ①-⑤-⑥-②-④-③ | C. | ③-④-②-⑥-⑤-① | D. | ②-⑤-①-④-③-⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
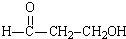 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com