
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO32-的中心原子均为sp3杂化 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | 分子晶体的堆积均采取分子密堆积 | |
| D. | CS2为V形的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碳酸钙加入到盐酸中:CO32-+2H+=CO2↑+H2O | |
| B. | 金属钾与水反应:K+H2O=K++OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铜屑:Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| D. | 向偏铝酸钠溶液中通过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
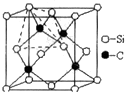 碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:
碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
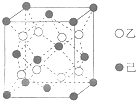 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.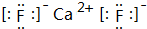 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 丙三醇和足量金属钠反应可以产生 3 mol H2 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色说明甲基对苯环性质有影响 | |
| C. | 丙烯的二氯代物有 5 种 | |
| D. | 芳香烃的通式是 CnH2n-6 (n≥6,n∈N) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com