
| A、工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 |
| B、硅单质可用于制造光导纤维 |
| C、2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 |
| D、固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
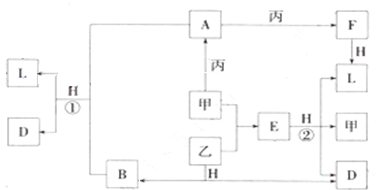
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、镁的金属活动性不如铷强,镁可置换出铷 |
| B、铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C、MgCl2的热稳定性比RbCl弱 |
| D、Rb单质比RbCl更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液显碱性 CO32-+2H2O?H2CO3+2OH- |
| B、碳酸氢钠溶液与过量澄清石灰水 HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、FeCl3溶液与Cu反应 Fe3++Cu=Fe2++Cu2+ |
| D、用氨水吸收少量二氧化碳 NH3?H2O+CO2=NH4++HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com