
分析 乙烯含有碳碳双键,乙炔含有C≡C,丁二烯含两个双键,甲苯含苯环、苯乙烯含有苯环和乙烯,都可与氢气发生加成反应,双键和氢气按1:1加成,三键和氢气按1:2完全加成,苯环和氢气按1:3完全加成,据此分析.
解答 解:(1)苯环与氢气按1:3反应,若烃与H2反应的物质的量之比为1:3,它是甲苯,故答案为:苯环;甲苯;
(2)碳碳三键或两个双键与氢气按1:2反应,若烃与H2反应的物质的量之比为1:2,它是乙炔或丁二烯,故答案为:三键、两个双键;乙炔、丁二烯;
(3)苯乙烯含有碳碳双键和苯环,则苯乙烯与H2完全加成的物质的量之比为1:4,故答案为:1:4.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃性质的考查,注意官能团的判断,苯环的性质,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
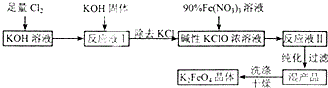 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
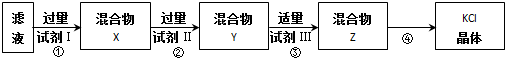
| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
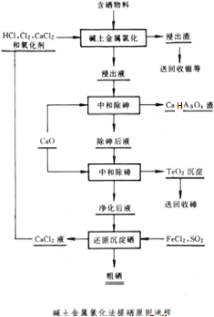
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
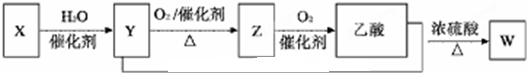
| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
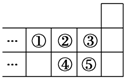
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
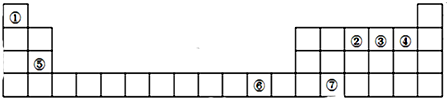
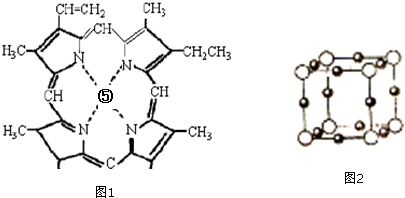
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com