
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)

(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:

则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。

①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
【答案】A D 3.612×1024(或6.NA) 平面三角形 sp2 BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键 7 六方BN晶体中层与层之间的作用力是较弱 的范德华力,故层与层之间相对易滑动 六方BN的结构中没有像石墨中有自由移动的电子, ![]() 或
或![]()
【解析】
根据价层电子对互斥理论分析分子的空间构型;根据晶胞中微粒的数目计算晶胞的密度。
(1) 能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低,由此分析,A能量最低,D能量最高,
故答案为:A、D;
(2) 硼酸中有B原子与3个羟基通过三对共用电子对结合,另外每个羟基中有1对共用电子对,所以1mol硼酸中共用电子对数为6NA个,
故答案为:6NA;
(3) BF3中B原子价层电子对个数=3+1/2×(3-3×1)=3,B原子价层电子对个数为3且不含孤电子对,所以为平面三角形结构;B的杂化类型为sp2;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是:BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键,
故答案为:平面三角形,sp2,BF3中B原子有空轨道,O(C2H5)2中氧原子上有孤对电子,能形成配位键;
(4) 单键是σ键,双键中含有1个σ键,从上述结构简式中可以看出还有3个C-H键,所以一共有7个σ键,
答案为:7;
(5) 由图示结构可以看出①六方BN具有良好的润滑性,是因为:六方BN晶体中层与层之间的作用力是较弱 的范德华力,故层与层之间相对易滑动;六方BN不能像石墨一样具有导电性,其原因是六方BN的结构中没有像石墨中有自由移动的电子;
②已知立方BN的晶胞参数为0.3615nm,则晶胞体积为:(0.3615![]() 10-7 )3cm3,晶胞中B原子数目为:8
10-7 )3cm3,晶胞中B原子数目为:8![]() 1/8+6
1/8+6![]() 1/2=4原子,N原子数目为:4,则立方BN的密度为:
1/2=4原子,N原子数目为:4,则立方BN的密度为:![]() ,
,
故答案为:![]() 。
。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列有关反应和反应类型不相符的是( )
A.苯制取环己烷-加成反应
B.苯与乙烯在催化剂存在下反应制取乙苯-取代反应
C.甲苯与酸性KMnO4溶液反应-氧化反应
D.甲苯与浓硝酸、浓硫酸混合反应制TNT-取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:[Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O.
2PbSO4+2H2O.

请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是_______________________________。
电解液中H2SO4的浓度将变__________,当外电路通过1 mol电子时,理论上负极板的质量增加_________,电池中消耗的硫酸物质的量为__________。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成______。B电极上生成_______,充电完成后,重新放电,A电极为________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得 其中含碳为72.0%、含氢为6.67%,其余为氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.
方法一:用质谱法分析得知A的相对分子质量为150.
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A所示.
方法三:利用红外光谱仪测得A分子的红外光谱如图B所示.
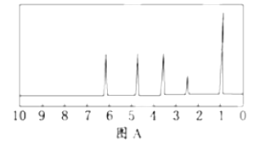

请填空:
(1)A的分子式为_____.
(2)A的分子中含一个甲基的依据是_____.
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)A可能的结构简式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ________________________。
(2)结合题目信息,写出电解饱和食盐水的化学反应方程式为 ___________________________ 。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换 ,SO2的作用是______,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为 _____________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出.该反应的离子方程式是 __________________________________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,混合溶液用 __________ 分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol H—N键吸收的能量为391 kJ,根据化学方程式:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
A. 431 kJB. 945.6 kJC. 649 kJD. 869 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中能大量共存的离子组是
A. Al3+、Cu2+、SO42-、Cl- B. Ba2+、K+、SO42-、NO3-
C. NH4+、Mg2+、SO42、Cl- D. Na+、Ca2+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 mol O2的质量是32g/mol
B. 阿伏加德罗常数的准确值就是6.02×1023
C. CO2的摩尔质量是44g/mol
D. 常温常压下22.4L氦气含有1 mol原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com