
高温下,某反应达到平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:单选题
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力.CO吸入肺中发生反应:CO+HbO2? O2+HbCO,37℃时,该反应的平衡常数K=220。若HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损.据此下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=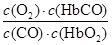 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,分别对反应C(S)+CO2(g) 2CO(g)(正反应吸热)进行如下操作(只改变该条件):
①升高反应体系的温度;②增加反应物C的用量;
③缩小反应体系的体积;④减少体系中CO的量。
上述措施中一定能使反应的反应速率显著加快的是( )
| A.①②③④ | B.①③④ | C.①② | D.①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在平衡体系2NO+O2 2NO2中通入18O组成的氧气,重新达到平衡后,则18O
2NO2中通入18O组成的氧气,重新达到平衡后,则18O
| A.只存在于O2中 |
| B.只存在于NO2中 |
| C.只存在于O2和NO2中 |
| D.存在于NO、O2、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C.向氯水中加CaCO3后,溶液漂白性增强 |
| D.Na2CO3溶液中加酚酞,溶液变红,加热,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)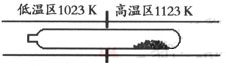
下列说法正确的是( )
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g) + O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
| A.是吸热反应 | B.是放热反应 | C.是熵减反应 | D.是熵增效应大于能量效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com