
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO 及少量的FeO、Fe2O3) 生产氯化铜晶体的流程如下:
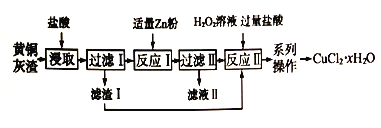
(1)反应I中所加Zn 粉不能过量的原因是_____________。
(2)滤液I中含有的主要金属阳离子是_____________。
(3) 写出反应II 的化学方程式_____________。
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、______、_____。
(5) 在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是_____________。
(6) 298K 时,向c (Cu2+) =0.02mol/L的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Cu2+是否沉淀完全? _____{列式计算,己知:Ksp[Cu(OH)2] =2.2×10-20,c(Cu2+)<1×10-5mol/L 视为沉淀完全}_____。
(7) CuCl2·xH2O晶体中x值的测定:称取3.420 g 产品溶解于适量水中,向其中加入含AgNO34.400×10-2mol 的AgNO3溶液(溶液中除Cl- 外,不含其他与Ag+反应的离子),待C1-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L 的KSCN 标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN 白色沉淀的形式析出。
①滴定终点的现象是__________。
②若滴定过程用去上述浓度的KSCN 标准溶液20.00mL,则CuCl2·xH2O中x值为_____。
【答案】 加入过量的Zn会使产品中含有杂质 Zn2+、Fe2+ Cu+H2O2+2HCl=CuCl2+2H2O 洗涤 干燥 Cu2+会水解 是 溶液pH=10,则c(OH-)=10-4mol/L,Ksp [Cu(OH)2]= c(Cu2+) c2(OH-) = c(Cu2+)×(10-4mol/L)2=2.2×10-20,此时c(Cu2+)=2.2×10-12<1×10-5mol/L,故Cu2+沉淀完全 溶液变为红色,且30s不褪色 2
【解析】黄铜灰中加入稀盐酸,稀盐酸可与Zn、CuO、ZnO、FeO、Fe2O3反应,滤渣1为铜,滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉先与Cu2+、H+反应生成铜单质,滤渣2主要为铜,与滤渣1合并为铜。铜在双氧水及过量盐酸反应生成氯化铜,在氯化氢的氛围中蒸发结晶得到氯化铜晶体。(1)反应I中所加Zn不能过量若加入过量的Zn会同时置换出铁,使产品中含有杂质;(2)滤液I中含有的主要金属阳离子是Zn2+、Fe2+;(3)反应II是铜在双氧水和盐酸中反应生成氯化铜和水,反应的化学方程式为Cu+H2O2+2HCl=CuCl2+2H2O;(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是Cu2+会水解产生氢氧化铜和盐酸,加热时盐酸挥发,最后剩下氢氧化铜;(6)溶液pH=10,则c(OH-)=10-4mol/L,Ksp [Cu(OH)2]= c(Cu2+) c2(OH-) = c(Cu2+)×(10-4mol/L)2=2.2×10-20,此时c(Cu2+)=2.2×10-12<1×10-5mol/L,故Cu2+沉淀完全;(7) ①滴定终点时SCN-遇铁离子遇红色,则现象是溶液变为红色,且30s不褪色;②与KSCN反应的银离子的物质的量为0.2000mol/L×0.020L=0.004mol,CuCl2·xH2O晶体n(Cl-)=4.400×10-2mol-0.004mol=0.0400mol,则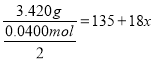 ,解得x=2。
,解得x=2。


科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
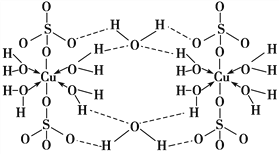
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质,并测定其结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量固体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)Y的电子式为___________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为______________。
实验(二):探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。
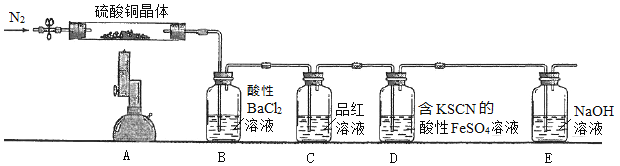
已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有________________________________。
(4)B、C装置的位置不能互换的原因是_______________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式___________________________。
实验(三):测定硫酸铜晶体中结晶水的含量。
取wg硫酸铜晶体(CuSO4·xH2O)配成250 mL 溶液,取25.00 mL 溶液用c mol/L EDTA溶液(简写成Y4—)滴定至终点,消耗EDTA标准液V mL。
已知:滴定方程式为:Cu2++ Y4—=CuY2—。
(6)x=___________________(用代数式表示)。
(7)下列情况会使测得的x偏小的是_______(填番号)
a、样品失去部分结晶水
b、量取待测液前未用待测液润洗滴定管
c、开始读数时滴定管尖嘴有气泡而终点时无气泡
d、滴定开始时平视、滴定终点时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中Ca2+、Mg2+、SO![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A. ②④⑤①③ B. ④②⑤①③ C. ②⑤④①③ D. ⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g)![]() CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)![]() CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
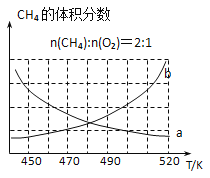
(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______。下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______;可逆反应③的平衡常数K=_______。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______v (逆),说明原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI
+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是_________;氧化产物与还原产物的物质的量比是__________;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是___________________________;
(3)若采用下图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)
(4)在容量瓶的使用方法中,下列操作正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(5)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的硫酸溶液500mL,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL,如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是_____________。
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)基态氮原子核外有________种不同运动状态的电子,其价层电子排布图为_______________
(2)NH4NO3中元素的第一电离能大小关系:N_______ O,NO3-的空间构型为___________,NH4+中氮原子的杂化类型为_________
(3)HCN分子中含______个σ和________个π键。与CN-互为等电子体的分子和离子分别为______和______(各举一例,填化学式)
(4)NH3极易溶于水,其主要原因是__________________________________________________________________
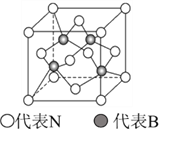
(5)立方氮化硼的结构与金刚石相似,其晶胞如图所示,B原子周围最近的N原子所构成的立体图形为_________,一个晶胞中N原子数目为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com