
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
【答案】3d54s1 K的原子半径比O大对核外电子的吸引力弱与O 小于 HCl为极性分子,且在水中极易电离出氢离子,氢离子与水形成稳定的水合离子 H2O 水分子之间存在氢键 三角锥形 σ  ×1030
×1030
【解析】
(1)与锰相邻的元素有Cr,Fe,Tc(锝,第五周期第ⅦB族),其中未成对电子数最多的为Cr,为24号元素,价电子排布为3d54s1;
(2)K的原子半径比O大对核外电子的吸引力弱与O,所以K的第一电离能小于O的第一电离能;
(3)HCl为极性分子,且在水中极易电离出氢离子,氢离子与水形成稳定的水合离子;水分子之间存在氢键,因此H2O的沸点高于HCl的沸点;
(4)KClO3晶体中阴离子为ClO3-,其中心原子价层电子对数为![]() ,含有一对孤电子对,所以空间构型为三角锥形;Cl原子采取sp3杂化,杂化轨道与O的2p轨道形成σ键;
,含有一对孤电子对,所以空间构型为三角锥形;Cl原子采取sp3杂化,杂化轨道与O的2p轨道形成σ键;
(5)金属K晶体为体心立方堆积,K原子半径为rpm,其体对角线上的3个K原子相切,设晶胞的棱长为a pm,则有![]() ,则其晶胞的棱长为a=
,则其晶胞的棱长为a=![]() pm,则晶胞的体积V=
pm,则晶胞的体积V=![]() pm3=
pm3=![]() ×10-30cm3;晶胞中K原子的数目为
×10-30cm3;晶胞中K原子的数目为![]() ,所以晶胞的质量m=
,所以晶胞的质量m=![]() ,所以晶体的密度为
,所以晶体的密度为 g﹒cm-3。
g﹒cm-3。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
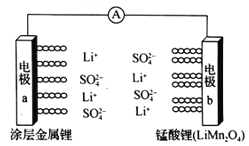
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成![]() 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
_________________________________________________________________。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
_________________________________________________________________。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种透明、不溶于水的坚硬固体。A固体在氧气中完全燃烧只得到一种无色无味气体,此气体能使澄清石灰水变浑浊,标准状况下测得此气体的密度是氧气密度的1.375倍。B固体能溶于热的苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色沉淀,此沉淀是一种比H2CO3还弱的酸,干燥后为不溶于水的白色粉末。B与石灰石、纯碱按一定比例混合加热后,能得到C,C在高温时软化,无固定熔点。根据以上事实,判断A、B、C各为何物:_______、_______、_______;写出有关反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷(![]() )的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
)的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
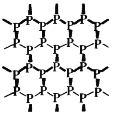
A.3.1g白磷中含P—P键的数目为0.3NA
B.6.2g磷烯中含六元环的数目为0.1NA
C.0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2![]() 4PH3,生成PH3分子的数目为0.4NA
4PH3,生成PH3分子的数目为0.4NA
D.0.1molP4发生反应P4+5O2=2P2O5,转移的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表所示化学反应与数据关系:

请回答:
(1)反应①是__填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式__。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=__(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施是__。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
(5)若反应③的逆反应速率与时间的关系如图所示:

可见反应在t1、t3、t7时都达到了平衡,而t2、t4、t8时都改变了一种条件,请判断改变的可能是什么条件:t2时__;t4时__;t8时__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
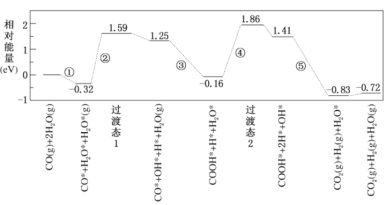
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com