
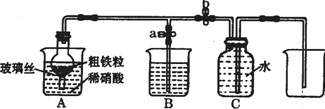
 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
分析 (1)①检验装置的气密性,使密闭容器内形成液面差即可;
②此装置是固体与液体不加热制取气体装置,据此解答即可;
(2)①硝酸的物质的量浓度c=$\frac{n}{V}=\frac{\frac{m}{M}}{V}$;
②一氧化氮的性质:极易和空气中的O2反应,与空气密度接近;
③铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,二氧化氮有毒;
④二氧化氮和水反应产物是一氧化氮;
⑤根据氧化还原反应中得失电子数目相等来回答;
⑥铁和硝酸反应的产物取决于铁的量的多少,亚铁离子具有还原性,能使高锰酸钾褪色,三价铁遇KSCN溶液显红色.
解答 解:(1)①关闭止水夹a和b,从A处烧杯中加入水,干燥管与烧杯中液面能形成液面差,所以能检验装置的气密性,故答案为:关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好;
②此装置是固体与液体不加热制取气体装置,固体采用块状或颗粒较大的固体,如大理石与稀盐酸制取二氧化碳气体,故答案为:块状或较大颗粒状固体与液体不需要加热反应生成;
(2)①硝酸的物质的量浓度c=$\frac{n}{V}=\frac{\frac{m}{M}}{V}=\frac{\frac{189g}{63g/mol}}{1L}$=3mol•L-1,故答案为:3mol•L-1;
②一氧化氮的性质:极易和空气中的O2反应,与空气密度接近,所以不能用排空气法,故答案为:NO与空气中的O2反应,NO与空气密度接近;
③铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,所以A装置的干燥管中观察到的现象是:有红棕色气体出现,二氧化氮有毒,属于酸性气体,可以用烧碱溶液吸收,故答案为:有红棕色气体出现;吸收NO2;
④二氧化氮和水反应产物是一氧化氮,所以若去掉B装置,对收集一氧化氮不会产生影响,故答案为:无影响;
⑤氧化还原反应中得失电子数目相等,Fe和HNO3均无剩余,金属铁全转化为亚铁,铁失电子的量为2amol,金属铁全转化为三价铁,铁失电子的量为3amol,金属铁的生成物既有亚铁离子又有三价铁离子是,铁失电子的量就2a~3amol之间,硝酸显示酸性和氧化性,显示酸性的硝酸和表现氧化性的硝酸的物质的量之比均为3:1,此时硝酸的转移电子的量为$\frac{3b}{4}$mol,故答案为:$\frac{3b}{4}$mol;
⑥铁相对于硝酸过量时,产物只有亚铁离子,亚铁离子具有还原性,能使高锰酸钾褪色,弱硝酸相对于硝酸不足时,产物只有三价铁离子,三价铁遇KSCN溶液显红色,有可能铁的两种价态均存在,故答案为:+2价或+3价或+2价和+3价;
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | 若溶液变血红色,说明含Fe3+,若溶液无明显变化,说明不含Fe3+ |
| 第二步 | 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 | 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
点评 本题是一道有关气体性质的大型综合题,题目综合性较强,难度较大,涉及实验装置气密性检查、实验方案的设计与评价.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 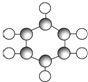 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com