
| A. | 甲、乙两杯溶液的物质的量浓度之间的关系为c(甲)=10c(乙) | |
| B. | 甲溶液中醋酸的电离程度小 | |
| C. | 中和等物质的量的NaOH,需要乙的体积是甲的10倍 | |
| D. | 甲乙等体积,与足量锌反应时,乙产生氢气的物质的量大 |
分析 醋酸为弱电解质,浓度越大,电离程度越小,甲的pH=2,乙的pH=3,则甲的浓度应大于乙的10倍,以此解答该题.
解答 解:A.酸的浓度越大,酸的电离程度越小,c(甲)>10c(乙),故A错误;
B.甲的浓度较大,浓度越大,电离程度越小,故B正确;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),故C错误;
D.甲的浓度较大,完全反应生成氢气的体积较大,故D错误.
故选B.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力,注意弱电解质的电离程度和浓度的关系是解答本题的关键,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | pH相同的HX、HY溶液,HY的物质的量浓度小 | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:Y->CO32->X->HCO3- | |
| D. | 向NaX溶液中通入CO2的化学方程式:2NaX+CO2+H2O=Na2CO3+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | SiO2→H2SiO3 | C. | Al→AlO2- | D. | Si→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在,Na+可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂均为固体 | |
| B. | 油脂在体内直接氧化产生热量 | |
| C. | 多吃动物脂肪比多吃植物油有利 | |
| D. | 有些脂肪酸是人体必需的,但在人体内却不能合成;脂肪中必需脂肪酸的含量越高,其营养价值越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和C4H8互为同系物 | |
| B. | CH2Cl2有2种同分异构体 | |
| C. | 苯乙烯分子中的所有原子不可能处于同一个平面 | |
| D. | 乙酸与乙醇的酯化反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
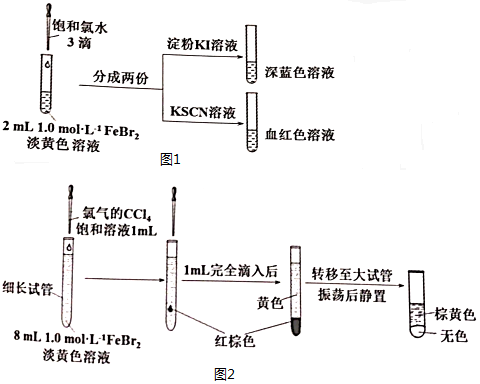
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③⑥ | C. | ②③ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
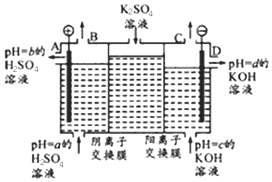
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com