
下表为元素周期表的一部分,其中编号代表对应的元素。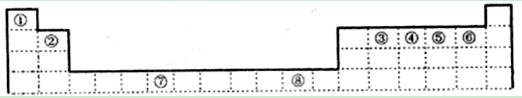
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,
(写出一种即可)其VSEPR构型为 。
(1)1s22s22p63s23p63d54s1(1分) ds (1分)
(2)sp2 sp3 (3)F > N> O>C;N2O,直线形
解析试题分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Cr,⑧为Cu,
(1)Cr的原子序数为24,则电子排布式为1s22s22p63s23p63d54s1,Cu的价电子排布为3d104s1,则位于元素周期表中的ds区,
(2)三种元素的质量比为1:6:16,原子个数比为=2:1:2,化合物对氢气的相对密度为23,相对分子质量为23×2=46,即为HCOOH,C原子采取sp2杂化方式, O原子采取sp3杂化方式,故答案为:sp2、sp3;
(3)因非金属性F>N,则第一电离能F>N,N-3的原子数为3,价电子数为3×5+1=16,而NO2+的原子数为3,价电子数为5+6×2-1=16,CO2的原子数为3,价电子数为4+6×2=16,则它们互为等电子体,结构相似来分析,已知二氧化碳为直线型,则N-3为直线型,故答案为:F;N;NO2+;直线型;
考点:本题考查物质的结构和性质,难度较大,熟悉元素的位置来推断元素,并熟悉电子排布式、杂化、氢键、配位键等知识来解答即可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题: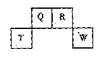
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的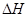 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;
(2)Z元素在周期表中的位置是 ;
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) ;
(4)写出X的单质在UW2中燃烧的化学方程式,并表示电子的转移方向和数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)U、V、X、Y、Z五种短周期元素,原子序数依次增大。U、V两元素最高正价与最低负价之和均为0;Y与U同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(用实际元素符号表示)________________;
(2)由这五种元素中的几种组成的化合物A、B、C、D有如下转化关系:
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式:___________________;
①如果B为两性不溶物,则A的化学式为_________,A转化为B的离子方程式为:__ __________;
②如果B由四种元素组成且溶液显碱性,则B含有的化学键类型是_______,A所属物质类别为_ ___________(填选项序号)。a.酸 b.碱 c.盐 d.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
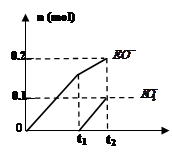
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
(1)画出D的原子结构示意图________,五种元素原子半径从大到小的顺序是________(填元素符号)。
(2)A与B形成的化合物中,含非极性键的化合物的结构式为 。
(3)C与B按原子个数比为1:1形成化合物的电子式是 。
(4)D、E所形成氢化物的稳定性由强到弱的顺序是 、 (填具体的化学式)。
(5)由短周期元素组成的某些微粒,如SO2、O3、NO2-可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-.CS2互称为等电子体的微粒是 (填符合要求所有微粒的名称)。
(6)写出工业上制E单质的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼元素B在化学中有很重要的地位。硼的化合物在农业、医院、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式 ,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图23是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为 。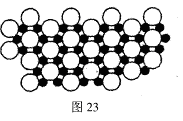
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com