
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
分析 加成反应是有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物.
解答 解:A.CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl,该反应中,乙烷中氢原子被氯原子取代,该反应属于取代反应,故A错误;
B.CH2=CH2+Br2→CH2Br-CH2Br,该反应中,双键变单键,为加成反应,故B正确;
C. ,该反应中,苯环上的氢原子被硝基取代生成硝基苯,属于取代反应,故C错误;
,该反应中,苯环上的氢原子被硝基取代生成硝基苯,属于取代反应,故C错误;
D.CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20,该反应中,酸中羟基被CH3CH2O-取代,属于取代反应,故D错误;
故选B.
点评 本题考查了加成反应的概念,难度不大,根据加成反应的概念判断即可.


科目:高中化学 来源: 题型:选择题
| A. | 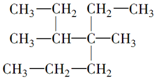 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. |  3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 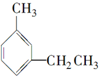 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
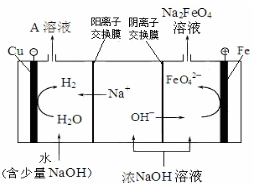
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
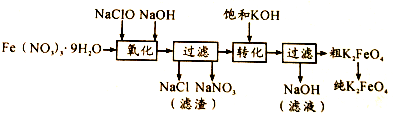
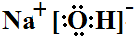 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
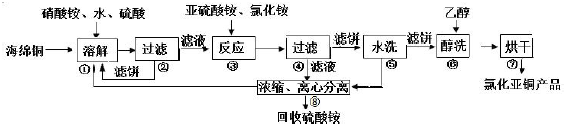
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
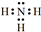 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com