
| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.亚铁离子水解溶液呈酸性,加入盐酸可以抑制亚铁离子的水解;
B.生成的气体为二氧化硫和二氧化碳,二氧化碳不会被吸收;
C.乙酸乙酯与氢氧化钠溶液反应,溶液不会分层,应该用饱和碳酸钠溶液吸收;
D.溶度积越小,难溶物越难溶,据此进行分析.
解答 解:A.亚铁离子发生水解生成氢氧化亚铁和氢离子,配制FeCl2溶液时加入适量的盐酸,可以抑制Fe2+水解,故A正确;
B.“黑面包实验”产生了CO2和SO2,SO2可以被KMnO4溶液吸收,CO2不可被KMnO4溶液吸收,故B错误;
C.乙酸乙酯能够与氢氧化钠溶液发生反应,乙酸乙酯蒸汽应导在饱和的Na2CO3溶液液面以上,而非NaOH,故C错误;
D.幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙,由于溶解度越小则Ksp越小,则溶度积Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH],故D正确;
故选AD.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及盐的水解应用、酯化反应、难溶物溶解平衡等知识,注意掌握盐的水解原理及其影响,B为易错点,注意生成气体为CO2和SO2.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
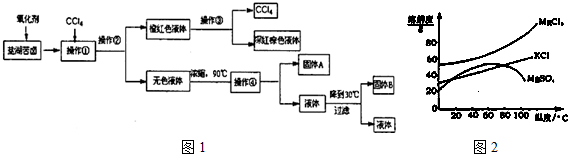
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 原电池是自发的氧化还原反应,电解池发生的是不自发的氧化还原发应 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
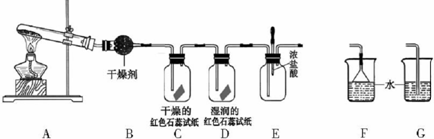
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com