
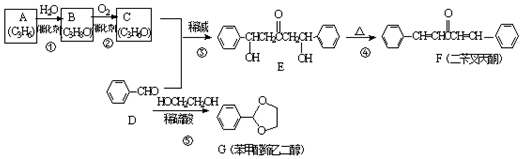
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是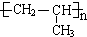 .
. .
. 分析 A和水发生加成反应生成B,其A符合单烯烃通式,则A结构简式为CH3CH=CH2,A与水发生加成反应生成B,B氧化生成C,C与苯甲醛反应生成E,结合E与苯甲醛结构简式可知C为 ,则B为
,则B为 ,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,以此解答该题.
,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,以此解答该题.
解答 解:(1)由以上分析可知B结构简式为 ,其名称是2-丙醇(异丙醇),故答案为:2-丙醇(异丙醇);
,其名称是2-丙醇(异丙醇),故答案为:2-丙醇(异丙醇);
(2)由官能团的变化可知③的反应类型是加成反应,④的反应类型是消去反应,故答案为:加成反应;消去反应;
(3)C的结构简式为 ,A为CH3CH=CH2,A加聚产物的结构简式是
,A为CH3CH=CH2,A加聚产物的结构简式是 ,故答案为:
,故答案为: ;
;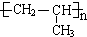 ;
;
(4)苯中所有原子共平面、乙烯中所有原子共平面、丙酮中C、O原子共平面,则F分子中所有的C原子可能共平面,则位于同一平面的碳原子最多有17个,
故答案为:17;
(5)G的芳香同分异构体中能发生银镜反应和水解反应,含有甲酸形成酯基,含有1个取代基,为-CH2CH2OOCH或者-CH(CH3)OOCH,含有2个取代基,为-CH3、-CH2OOCH,或者-CH2CH3、-OOCH,各有邻、间、对3种,含有3个取代基为2个-CH3、-OOCH,2个-CH3有邻、间、对3种,对应-OOCH位置分别有2种、3种、1种,符合条件的同分异构体共有14种,其中核磁共振氢谱只有四组峰的同分异构体结构简式为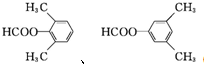 ,
,
故答案为:14;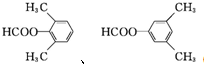 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,正确判断A结构简式是解本题关键,根据分子式、结构简式解反应条件采用正逆结合的方法进行推断,难点是(5)题同分异构体种类判断,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
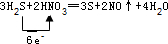 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  属于芳香族化合物 属于芳香族化合物 | B. | 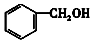 属于酚类化合物 属于酚类化合物 | ||
| C. | 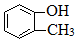 属于脂环化合物 属于脂环化合物 | D. | CH3 CH2CH(CH3)2属于链状化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com