
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
分析 A.铜离子为有色离子;
B.pH=12的溶液中存在电离氢氧根离子,5种离子之间不反应,都不与氢氧根离子反应;
C.加入铝片能放出H2的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子、铜离子之间发生双水解反应,铁离子与氢氧根离子反应,碳酸氢根离子与氢离子和氢氧根离子反应;
D.由水电离出的c(H+)=1×10-12 mol/L的溶液为酸性或碱性溶液,铵根离子与氢氧根离子反应.
解答 解:A.Cu2+为有色离子,在溶液中不能大量共存,故A错误;
B.pH=12的溶液为碱性溶液,溶液中存在大量氢氧根离子,K+、Na+、SO42-、CH3COO-、CO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.加入铝片能放出H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-、Cu2+之间发生双水解反应,HCO3-、Cu2+都与氢氧根离子反应,HCO3-与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.由水电离出的c(H+)=1×10-12 mol/L的溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O含有的原子数为NA | |
| B. | 4gH2含有氢分子数4NA | |
| C. | 常温常压下,11.2L O2中含有分子数为0.5NA | |
| D. | 1L 0.1 mol•L-1NaCl溶液中含Na+数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L的NaCl溶液 | B. | 150ml 3mol/LKCl溶液 | ||
| C. | 75ml 2mol/L的NH4Cl溶液 | D. | 50ml 1mol/lCuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
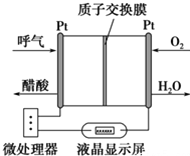 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| B. | 该电池的正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1 mol AlN需转移3 mol电子 | |
| C. | AlN中氮元素的化合价为+3价 | |
| D. | AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:D>C>B>A | B. | 氢化物的稳定性:H2C>HD | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 氧化性:A2+>B+,还原性:C2-<D- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
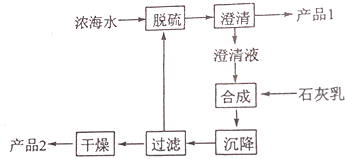
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
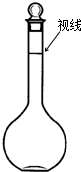 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com