
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.分析 (1)反应达到平衡时,各物质浓度不再随时间的变化而变化,根据v=$\frac{△c}{△t}$计算反应速率,;
(2)根据AB的浓度变化计算A2的浓度变化,从而得出a值,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,根据温度对化学平衡常数的影响判断;
(3)上述反应达到平衡后,第4min时,若把容器的体积快速扩大一倍,AB的浓度变为原来的一半,该反应反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,据此画出图象;
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol,在2L容器中有Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,根据Qc和Kc的关系判断平衡移动的方向;将AB(g)全部折算成A2(g)、B2(g)可知,开始时向此容器中加入的A2(g)、B2(g)的物质的量分别为0.8mol、0.6mol与题中的A2(g)、B2(g)的物质的量分别为0.8mol、0.6mol相等,根据等效平衡的原理进行答题.
解答 解:(1)反应达到平衡时,各物质浓度不再随时间的变化而变化,根据图可知3min时反应达到平衡状态,在根据v=$\frac{△c}{△t}$可知,用AB表示的平均反应速率为$\frac{0.5}{3}$mol/(L•min)=$\frac{1}{6}$mol/(L•min),
故答案为:3;$\frac{1}{6}$;
(2)根据图可知,AB的浓度变化为0.5mol/L,则A2的浓度变化为0.25mol/L,所以a=0.4mol/L-0.25mol/L=0.15mol/L,平衡时的浓度为0.3mol/L-0.25mol/L=0.05mol/L,该反应的化学平衡常数Kc=$\frac{0.{5}^{2}}{0.15×0.05}$=$\frac{100}{3}$,由于该反应是放热反应,所以温度升高,平衡逆向移动,Kc值减小,
故答案为:0.15mol/L;$\frac{100}{3}$;减少;
(3)上述反应达到平衡后,第4min时,若把容器的体积快速扩大一倍,AB的浓度变为原来的一半,该反应的反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,导致AB的浓度不变,所以其图象为: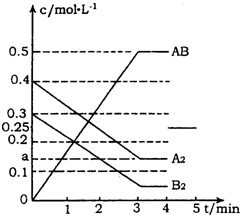 ,
,
故答案为: ;
;
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol,在2L容器中有Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,Kc=$\frac{100}{3}$,所以Qc<Kc,所以平衡向正反应方向移动,将AB(g)全部折算成A2(g)、B2(g)可知,开始时向此容器中加入的A2(g)、B2(g)的物质的量分别为0.8mol、0.6mol与题中的A2(g)、B2(g)的物质的量分别为0.8mol、0.6mol相等,即两个平衡为等效平衡,所以各物质的体积分数不变,故选③,
故答案为:正;Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,Kc=$\frac{100}{3}$,Qc<Kc,所以平衡向正反应方向移动;③.
点评 本题考查化学反应速率、化学平衡的有关计算、等效平衡等,难度中等,(4)中注意对等效平衡规律的理解,注意该反应特点.


科目:高中化学 来源: 题型:解答题
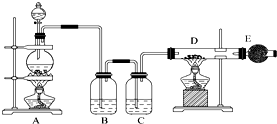 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绝热容器,温度不再改变 | |
| B. | 恒容时,压强不在改变 | |
| C. | 恒压时,体积不在改变 | |
| D. | 断裂2 mol O-H键同时形成1molH-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,分散在空气中不可能形成胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | 氯化钠固体、液态氯化氢都不导电,都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com