
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1) E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(用化学式表示);写出C与A形成的18e-化合物的电子式 ,
该化合物类型为 (填“共价化合物”或“离子化合物”)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
;写出题中生成M的化学方程式
(1)第三周期、第ⅣA族;离子键和极性共价键;
(2)H2O>NH3>SiH4, 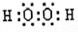 ,共价化合物;
,共价化合物;
(3)SiO2+2OH-=SiO32-+H2O, NH3+HNO3=NH4NO3。
【解析】
试题分析:根据题意知,A、B、C、D、E五种短周期元素,E的单质可做半导体材料,则E为硅元素;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B为氮元素,M为NH4NO3,1mol中含有42mol电子;B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为1,又D的原子序数最大,则D为钠元素;A、D同主族,且A的原子序数和原子半径都最小,A为氢元素;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是SiO2和NaOH的反应,则C为氧元素。(1) E为硅元素,在周期表中的位置第三周期、第ⅣA族;化合物M为NH4NO3,含有的化学键类型有离子键和极性共价键;(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,C与A形成的化合物中,H2O2含有18个e-,其电子式为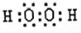 ,该化合物类型为共价化合物;(3)C与E两元素形成的化合物SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,生成NH4NO3的化学方程式为NH3+HNO3=NH4NO3。
,该化合物类型为共价化合物;(3)C与E两元素形成的化合物SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,生成NH4NO3的化学方程式为NH3+HNO3=NH4NO3。
考点:考查元素推断、元素周期律及相关物质的结构和性质,


科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高二化学试卷(解析版) 题型:选择题
下列有机物可以形成顺反异构的是:( )
A、丙烯 B、1-氯丙烯 C、2-甲基-2-丁烯 D、2,3-二甲基-2-丁烯
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:

下列说法正确的是( )
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入过量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化
合物共有3种
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应
Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
分子式为C5H11OH的同分异构体共有(不考虑立体异构)( )
A.6种 B.7种 C. 8种 D.9种
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为-571.6 kJ·mol-1
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:选择题
下列除杂,所用试剂和操作均正确的是
选项 | 物质成分(括号内为杂质) | 所用试剂 | 操作 |
A | 铁屑(油污) | 纯碱溶液 | 洗涤 |
B | 苯(苯酚) | 溴水 | 过滤 |
C | 碳酸钡(硫酸钡) | 盐酸 | 溶解、过滤 |
D | 乙醇(乙酸) | 烧碱溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.煤经过气化和液化等物理变化可以转化为清洁燃料
B.侯氏制碱法的工艺过程,应用了物质溶解度的差异
C.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
D.甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com