
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol[Zn(NH3)4]Cl2中含有σ键的数目为16 NA
B.电解精炼粗铜时,每转移NA电子,阳极上溶解的铜原子数必为0.5 NA
C.3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA
D.60 g石英晶体中含有的Si—O键数目为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
“钴酞菁(分子直径1.3×10–9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性。下列关于“钴酞菁”的说法正确的是
A.在水中形成的分散系属于悬浊液
B.在水中形成的分散系属于胶体
C.分子直径比Na+小
D.“钴酞菁”分子既能透过滤纸,也能透过半透膜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列有关元素的性质及其递变规律正确的是
A.同主族元素形成的单质熔沸点自上而下逐渐升高
B.核外电子排布相同的微粒化学性质不一定相同
C.同主族元素含氧酸的酸性随核电荷数的增加而减弱
D.非金属元素的气态氢化物的稳定性越强其沸点就越高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是
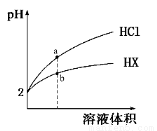
A.稀释前,c(HX)=0.01 mol/L B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-) D.溶液的导电性:a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:推断题
(16分)有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
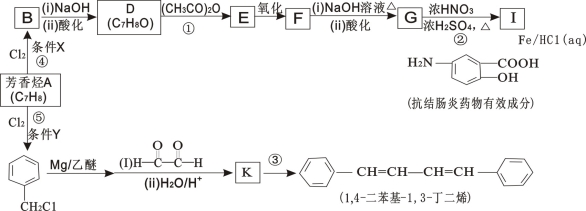
已知:
Ⅰ.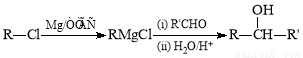 (R、R`表示烃基)
(R、R`表示烃基)
Ⅱ.
Ⅲ.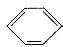
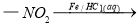

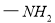
Ⅳ.

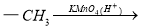

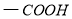
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是 。
(2)D的结构简式是_______________
(3)写出F与NaOH反应的化学方程式 。
(4)下列说法正确的是________(填选项字母)。
A.④的反应条件X和⑤的反应条件Y完全相同
B.①②④⑤反应类型相同
C.G不可以发生缩聚反应
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化
(5)检验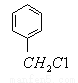 有氯原子的方法是 。
有氯原子的方法是 。
(6)③的化学方程式是 。
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式: 。
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3∶2∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:实验题
(14分)硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:

反应釜中发生反应:4NH4Cl+Mg2 Si 4NH3↑+SiH4↑+2MgCl2 △H<0
4NH3↑+SiH4↑+2MgCl2 △H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于 晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是 。
(2)上述生产硅烷的过程中反应釜抽真空的原因是 。
(3)液氨参与循环的作用是 。
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是 。
(5)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与胃酸反应的化学方程式是 。若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8·nH2O中n的值是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
下列有关实验操作设计、现象记录、结论解释都正确的是
实验操作设计 | 现象记录 | 结论解释 | |
A | 将少量浓硝酸逐滴加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
B | 用坩埚钳夹住铝箔在酒精灯上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
D | 向紫色石蕊试液中持续长时间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三下学期一模考试理综化学试卷(解析版) 题型:填空题
(12分)【化学——有机化学基础】松油醇(G)可用于配制香精,其合成路线如下:
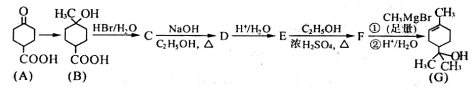
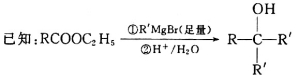
请回答下列问题:
(1)G所含两种官能团的名称分别是________、__________。
(2)同时符合下列两个条件的B的同分异构体有____________种。
i.含有六元碳环,碳环上仅有两个取代基且呈对位;
ii.在一定条件下能发生银镜反应、水解反应和消去反应。
(3)为了鉴别E和F,宜选用下列试剂中的_______作鉴别试剂(填下列序号字母)。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.NaHCO3溶液
(4)C→D的化学方程式为_________________。
(5)物质A(分子式为C7H10O3)催化氢化得到H(分子式为C7H12O3),H在一定条件下可以生成高聚物I,I的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三下学期第一次模考理综化学试卷(解析版) 题型:填空题
(14分)以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g) △H=+ 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式 .
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则 .
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组实验中以NH3表示反应的速率是 ,与前三组相比,NH3 生成量最小的原因可能是 .
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是 .请用电离平衡理论解释上述实验现象 .
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 .
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com