
(8 分)实验室有 NaHSO4 ,Ba(OH)2, NH3 • H2O NaHCO3、KAl(SO4)2 五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:
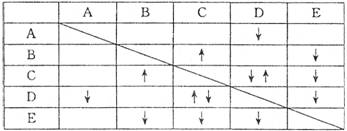
表中“ ”表示生成气体物质,“
”表示生成气体物质,“ ”表示生成沉淀。
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2) 写出A的电离方程式___________________________:;
(3) C、D两溶液反应的离子方程式为___________________________;
(4) 向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
(8分) (1)NaHSO4、Ba(OH)2 (2分) (2)NH3·H2ONH4++OH-(2分)
(3)Al3++3HCO3-= Al(OH)3↓+3CO2↑(2分) (4) 0.25 (2分)
【解析】本题考查物质检验和推断。解题的关键是找到突破点——既产生沉淀又产生气体的两种物质是NaHCO3、KAl(SO4)2,能发生双水解反应生成Al(OH)3沉淀和CO2气体,结合图表,C只能与另一种物质产生沉淀,故C为NaHCO3,E为Ba(OH)2,D为KAl(SO4)2,与NaHCO3产生气体的只有另一种物质NaHSO4,故B为NaHSO4,NH3 • H2O只能与KAl(SO4)2产生沉淀,故A为NH3 • H2O,综上所述,A、B、C、D、E分别为NH3 • H2O、NaHSO4、NaHCO3、KAl(SO4)2、Ba(OH)2。(1) B、E的化学式分别为NaHSO4、Ba(OH)2(2)NH3 • H2O是弱电解质,部分电离,电离方程式为NH3·H2ONH4++OH-。(3) NaHCO3、KAl(SO4)2发生双水解反应生成Al(OH)3沉淀和CO2气体,反应的离子方程式为Al3++3HCO3-= Al(OH)3↓+3CO2↑。(4) 0.1 mol溶质的KAl(SO4)2溶液滴加Ba(OH)2溶液,当Al3+全部沉淀时,沉淀量最大,产生0.1molAl(OH)3沉淀和0.15molBaSO4,故所生成沉淀的物质的量之和最多为0.25mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(8分)实验室有NaHSO4 ,Ba(OH)2, NH3 • H2O NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:
表中“”表示生成气体物质,“
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2)写出A的电离方程式___________________________:;
(3)C、D两溶液反应的离子方程式为___________________________;
(4)向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
查看答案和解析>>
科目:高中化学 来源:2012届河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:填空题
(8分)实验室有 NaHSO4 ,Ba(OH)2, NH3 ? H2O NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:
表中“ ”表示生成气体物质,“
”表示生成气体物质,“ ”表示生成沉淀。
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2) 写出A的电离方程式___________________________:;
(3) C、D两溶液反应的离子方程式为___________________________;
(4) 向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省唐山一中高一第一学期第一次月考化学试卷(带解析) 题型:实验题
(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为 。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年河北省高一上学期期中考试化学卷 题型:填空题
(8分)实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
完成下列问题:
(1)该反应中氧化剂是_____________;还原产物是_____________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?有多少克KMnO4参加了反应?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com