
【题目】已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示[部分产物略去]。下列说法错误的是
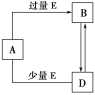
A.A、B、D可能是钠及其化合物B.A、B、D可能是铁及其化合物
C.A、B、D可能是铝及其化合物D.A、B、D不可能是非金属及其化合物
【答案】D
【解析】
A、假设A、B、D含钠及其化合物,A为NaOH,E为CO,NaOH与过量的CO2反应生成NaHCO3,即B为NaHCO3,NaOH与少量的CO2反应生成Na2CO3,即D为Na2CO3,NaHCO3受热分解成Na2CO3,Na2CO3与CO2、H2O反应生成NaHCO3,符合该转化关系,故A说法正确;
B、假设A、B、D可能是铁及其化合物,令A为Fe,E为HNO3,铁与过量的HNO3反应生成Fe(NO3)3,铁与少量的HNO3反应生成Fe(NO3)2,Fe(NO3)3与Fe反应生成Fe(NO3)2,Fe(NO3)2与氧化剂反应生成fFe(NO3)3,符合转化关系,故B说法正确;
C、假设A、B、D为铝及其化合物,令A为AlCl3,E为NaOH,AlCl3与过量的NaOH反应生成NaAlO2,AlCl3与少量的NaOH溶液反应生成Al(OH)3,AlO2-与H+反应生成Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2,符合转化关系,故C说法正确;
D、假设A、B、D为碳及其化合物,令A为C,E为O2,C与足量的O2反应生成CO2,与少量的O2反应生成CO,CO2与C反应生成CO,CO与O2反应生成CO2,符合转化关系,因此A、B、D可能是非金属及其化合物,故D说法错误;
答案为D。


科目:高中化学 来源: 题型:
【题目】可逆反应:![]() (所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
(所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
① 混合气体的压强不再改变的状态
② 单位时间内生成n mol NO2的同时生成2n mol O2
③ 用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤
C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是

A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1molL-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实线表示元素周期表的部分边界。

(1)请在上表中用实线补出元素周期表的上边界。_____________
(2)某主族元素原子的核外电子排布为: ,该元素在元素周期表中的位置为_______________。
,该元素在元素周期表中的位置为_______________。
(3)元素I的非金属性________(填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,______________________,非金属性增强。设计实验证明元素E的金属性强于元素F:_______________________________________。
(4)处于周期表中对角线位置(左上方和右下方) 的元素,其性质具有相似性,称为“对角线规则”。元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质。回答下列问题。
①写出F的单质与氢氧化钠溶液反应的离子方程式___________________________。
②鉴别元素D与E的氢氧化物可用试剂是_________________。
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为: ,请写出该酸与过量氢氧化钠溶液反应的化学方程式_________________________________。
,请写出该酸与过量氢氧化钠溶液反应的化学方程式_________________________________。
信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中羟基氢方可电离出H+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组模拟上述过程,所设计的装置如图所示:
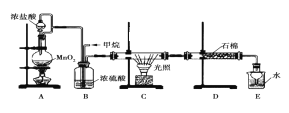
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③_______________________。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_______________________。
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷胺是最早用于抑制流感病毒的抗疾病毒药,其合成路线如图所示。下列说法不正确的是( )
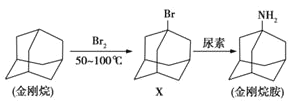
A. 金刚烷的分子式是C10H16B. X的一种同分异构体是芳香族化合物
C. 上述反应都属于取代反应D. 金刚烷的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参照元素①-⑧在表中的位置,根据判断出的元素回答问题:
① | |||||||
② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧原子的最外层电子的轨道表达式为___________________,关于它的最外层p亚层电子的说法错误的是_________。(填序号)
a. 能量相同 b.电子云形状相同
c. 自旋方向相同 d. 电子云伸展方向相同
(2)③和①组成的四核分子的化学式为___________,空间构型为_____________,属于_____分子(填“极性”或“非极性”)。
(3)比较④、⑤元素常见离子的半径大小(用化学式表示)______>_____;②、③ 两元素非金属性较强的是 ______(写元素符号),写出证明该结论的一个事实:___________________________ 。
(4)④、⑤元素形成的四原子化合物的电子式为 ___________ ;已知⑥元素的氧化物的熔点为2054℃,且以它为原料,可以通过电解的方法得到铝,据此推断⑥元素的氧化物为_________晶体(填“分子晶体”或“离子晶体”或“原子晶体”或“金属晶体”)。⑥元素的氧化物熔点______⑥元素的氯化物熔点(填“大于”“小于”“等于”),请解释其原因______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com