
(14分)已知SO2可以用Fe(NO3)3溶液吸收,某学习小组据此按下图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成, 装置B中产生白色沉淀。
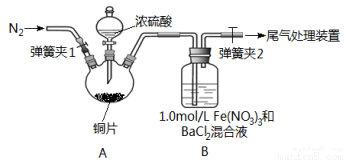
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为 ;检查图中连通装置A、B气密性的方法是 。
(2)加入浓硫酸之前先通人N2一段时间,其目的是 ;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是 。若用氢氧化钠溶液处理尾气,则发生反应的离子方程式为 。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应。
假设2: 。
假设3:Fe(NO3)2溶液显酸性,在此酸性条件下NO3能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0molL1Fe(NO3)3溶液的pH; ② ③ ④ |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
下列关于实验的描述错误的是
A.将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体
B.测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱
C.萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗
D.检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:推断题
(B)(13分)根据以下转化关系(所有无机产物均已略去)。回答下列各问:
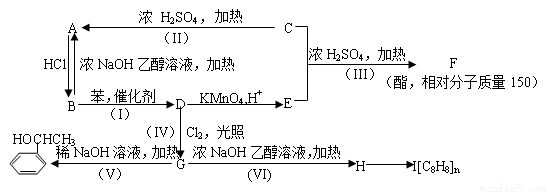
(1)在编号(I)~(VI)的六个反应中,属于取代反应的有(填反应编号) 。
(2)写出指定物质的结构简式:F ;I 。
(3)写出下列反应的化学方程式:
B转化为D的化学方程式: 。
G转化为H的化学方程式: 。
(4)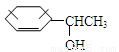 的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
(B)下列方程式表示的反应既不属于加成反应也不属于取代反应的是
A.C6H5CH2Cl+NaCN → C6H5CH2CN+NaCl
B.C6H5Li+CO2 → C6H5COOLi
C.CH3CH2CHO+HCN→CH3CH2CH(CN)OH
D、CH3COOCH2CH3 CH3COOH+CH2=CH2
CH3COOH+CH2=CH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
A.食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+
B.纯碱溶液呈碱性的原因是:CO32 -+2H2O H2CO3+2OH-
H2CO3+2OH-
C.用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O Fe(OH)2+H2↑
Fe(OH)2+H2↑
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l); H=-571.6KJ·mol—1
H=-571.6KJ·mol—1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:
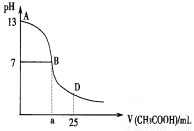
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
(15分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g)  2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
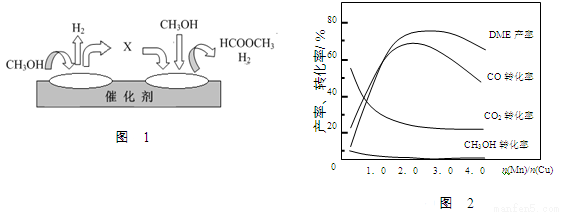
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
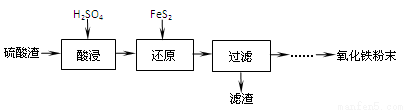
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
对下列装置作用的分析或解释正确的是


A.装置甲可除去HCl中的Cl2杂质
B.装置乙可吸收SO2,并防止倒吸
C.装置丙石灰水变浑浊即可证明非金属性:Si>C
D.装置丁可制取并收集NO气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染
B.物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化
C.氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力
D.农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com