
| A. | CO2的电子式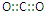 | |
| B. | CCl4的比例模型: | |
| C. | 含有18个中子的氯原子的核素符号:${\;}_{17}^{35}$Cl | |
| D. | 硫原子的结构示意图: |
分析 A.二氧化碳为共价化合物,分子中存在两个碳氧双键,该电子式中漏掉了氧原子的2对孤电子对;
B.四氯化碳的比例模型中,Cl原子的相对体积应该大于C原子;
C.质量数=质子数+中子数,元素符号的左上角表示质量数、左下角表示质子数;
D.硫原子的核电荷数=核外电子总数=16,最外层为6个电子.
解答 解:A.二氧化碳分子中存在两个碳氧双键,C、O原子最外层都达到8电子稳定结构,二氧化碳正确的电子式为: ,故A错误;
,故A错误;
B.四氯化碳中,氯原子半径大于碳原子,四氯化碳正确的比例模型为: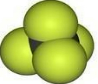 ,故B错误;
,故B错误;
C.含有18个中子的氯原子的质量数为35,该核素符号可以表示为:${\;}_{17}^{35}$Cl,故C正确;
D.硫原子的核电荷数、核外电子总数都是16,最外层为6个电子,硫原子正确的原子结构示意图为: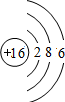 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的书写方法,题目难度中等,涉及原子结构示意图、电子式、比例模型、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
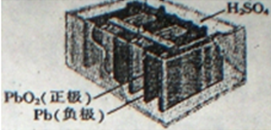
| A. | 铅蓄电池属于二次电池,充电时电能转化为化学能 | |
| B. | 电池工作时,电子由Pb板通过导线流向PbO2板 | |
| C. | 电池工作时,负极反应为:Pb-2e-═Pb2+ | |
| D. | 电池工作时,H+移向PbO2板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、Cl-、Na+ | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | c(H+)=1.0×10-13 mol•L-1溶液中:C6H5O-、K+、SO42-、Br- | |
| D. | 能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com