
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2=== +2FeS+SO2(已配平),则下列关于该反应的说法错误的是
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素 Ce、
Ce、 Ce、
Ce、 Ce、
Ce、 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
A.含有NA个氮气和乙烯分子的混合气体质量为28g
B.标准状况下,11.2L氦气中含有NA个氦原子
C.将NA个NH3分子溶于lL水中得到lmol/的氨水
D.100mL 0.1mol/LAlCl3溶液含有0.01NA个A13+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
下列有相关说法不正确的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.在任何条件下,纯水都呈中性
C.水的离子积常数Kw随温度、外加酸(碱)浓度的改变而改变
D.铅蓄电池充电时,标有“—”的电极应与电源的负极相连
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.浓硫酸有吸水性,可用于干燥氨气和二氧化硫
B.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
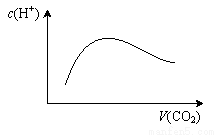
A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如上图变化关系
B.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列过程属于化学变化的有
①白色的硫酸铜粉末久置于空气中变成蓝色;②同素异形体之间的互变; ③福尔马林用来浸制标本;④氯化钠溶液通电后导电;⑤蜂蚁螫咬处涂稀氨水或小苏打溶液可以减轻痛苦;⑥同分异构体之间的互变
A.3个 B.4个 C.5个 D.6个
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
以硫酸铜作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
①粗铜与直流电源负极相连;
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
A.①③ B.②④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二第一学期化学试卷(解析版) 题型:实验题
(10分)实验室中有一未知浓度的稀盐酸,某学在实验室中进行测定盐酸浓度的实验,请完成下列填空。
(1)配制100 mL 0.10 mol·L-1 NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶,贴上标签。
②托盘天平称量 g氢氧化钠固体。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度/(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
1 | 0.10 | 22.58 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com