
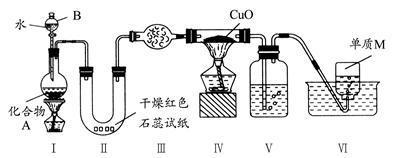
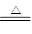 3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝

 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验操作 |
| A | 鉴别乙酸乙酯和乙酸 | 分别加入饱和Na2CO3溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 比较H2O和乙醇中羟基氢的活泼性 | 分别加入少量Na |
| D | 比较I2在H2O和CCl4中的溶解度 | 向I2水中加入CCl4,振荡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
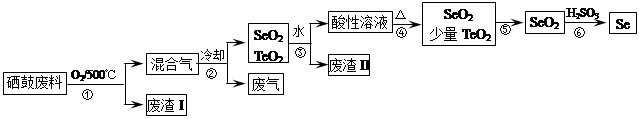
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
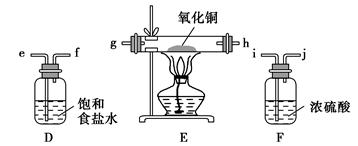
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将高锰酸钾晶体加热分解,所得固体质量减小 |
| B.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫色褪去,表明MnO4-为紫色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
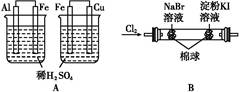
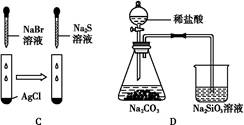
| 实验 | 实验现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 金属活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
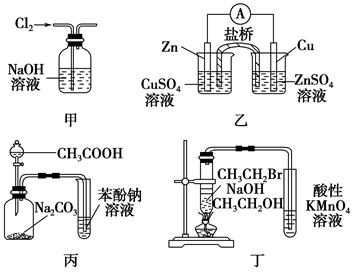
| A.图甲:除去Cl2中含有的少量HCl |
| B.图乙:构成锌—铜原电池 |
| C.图丙:根据实验现象推知酸性CH3COOH>H2CO3>C6H5OH |
| D.图丁:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
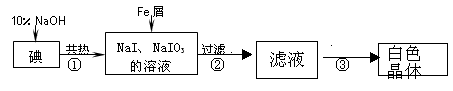
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 |  |
| 取少量溶液液于试管A中, . | 溶液显蓝色 | 溶液中含IO3一 |
| 另取少量溶液液于试管B中, . | . | 溶液中含大量0H一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com