
【题目】I.写出下列典型物质的电离方程式
(1)H2SO4_________________________________________
(2)Fe(OH)3________________________________________
(3)NaHSO4_________________________________________
(4)NaHCO3________________________________________
(5)Al2O3(熔融)____________________________________
II.写出下列典型反应的离子方程式:
(1)在稀H2SO4中加入CH3COONa溶液___________________________________
(2)氧化镁溶于稀硫酸______________________________________________
(3)CuSO4溶液与Ba(OH)2溶液混合_______________________________________
(4)NaHCO3溶液与稀盐酸混合________________________________________
(5)NaHSO4溶液与NaOH溶液混合_____________________________________
【答案】H2SO4===2H++SO42- Fe(OH)3![]() Fe3++3OH- NaHSO4===Na++H++SO42- NaHCO3===Na++HCO3-、 Al2O3
Fe3++3OH- NaHSO4===Na++H++SO42- NaHCO3===Na++HCO3-、 Al2O3![]() 2Al3++3O2- CH3COO-+H+===CH3COOH MgO+2H+===Mg2++H2O Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ HCO3-+H+===H2O+CO2↑ H++OH-===H2O
2Al3++3O2- CH3COO-+H+===CH3COOH MgO+2H+===Mg2++H2O Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ HCO3-+H+===H2O+CO2↑ H++OH-===H2O
【解析】
I. (1)硫酸为强电解质,在溶液中完全电离;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3![]() Fe3++3OH-;
Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;
(5) Al2O3(熔融)是强电解质,熔融时完全电离;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠;
(5) NaHSO4溶液与NaOH溶液混合生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆。
I. (1)硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4===2H++SO42-,故答案为:H2SO4===2H++SO42-;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3![]() Fe3++3OH-,故答案为:Fe(OH)3
Fe3++3OH-,故答案为:Fe(OH)3![]() Fe3++3OH-;
Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离,电离方程式为NaHSO4===Na++H++SO42-,故答案为:NaHSO4===Na++H++SO42-;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;电离方程式为:NaHCO3===Na++HCO3-;故答案为:NaHCO3===Na++HCO3-;
(5) Al2O3(熔融)是强电解质,熔融时完全电离,电离方程式为:Al2O3 ![]() 2Al3++3O2-;故答案为:NaHCO3===Na++HCO3-;
2Al3++3O2-;故答案为:NaHCO3===Na++HCO3-;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆,离子反应为CH3COO-+H+=CH3COOH;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆,离子方程式为:MgO+2H+===Mg2++H2O;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为:Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠,反应的化学方程式为:NaHCO3+HCl=CO2↑+H2O+NaCl;碳酸氢钠、氯化氢都是可溶性的强电解质,离子方程式中需要拆开,二氧化碳、水需要保留分子式,该反应的化离子方程式:HCO3-+H+==CO2↑+H2O;
(5) NaHSO4溶液与NaOH溶液混生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆,该反应的化离子方程式:H++OH-===H2O。


科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
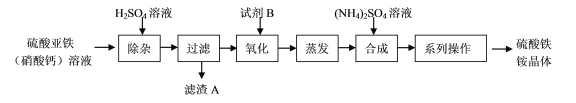
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是( )
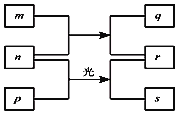
A.原子半径的大小![]()
B.元素的非金属性![]()
C.Y的氢化物常温常压下为气态
D.X的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
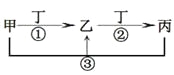
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23g Na与足量H2O反应完全后可生成NA个H2分子
B.标准状况下,11.2L H2O中含有的氧原子数为0.5NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.16g O2含有的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
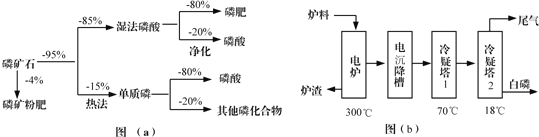
【题目】化学一选修:化学与技术磷矿石主要以[Ca3(PO4)2H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的____________;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:___________,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸___________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是___________(填化学式),冷凝塔1的主要沉积物是___________,冷凝塔2的主要沉积物是___________。
(4)尾气中主要含有___________,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去___________;再通入次氯酸钠溶液,可除去___________(均填化学式)。
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
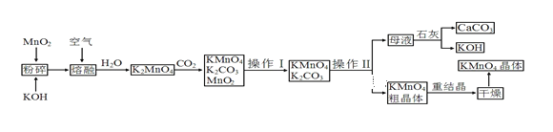
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C 苯酚 D “84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________;
(3)上述流程中可以循环使用的物质有石灰、CO2、____,____;(写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___________。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为( )

A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com