
 MnCl2+Cl2↑+2H2O,设Mn元素全部以Mn2+的形成存在于反应后的溶液中),又收集到bmol单质气体。
MnCl2+Cl2↑+2H2O,设Mn元素全部以Mn2+的形成存在于反应后的溶液中),又收集到bmol单质气体。科目:高中化学 来源: 题型:
| ||
| 熔融 |
| ||
| 熔融 |
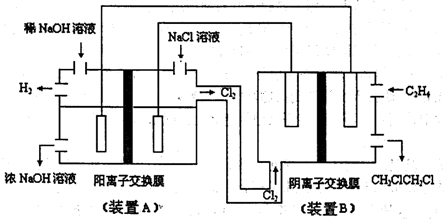
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
通过下列变化所得到的物质属于纯净物的是:
A. 体积比为2∶1的SO2和O2的混合气体在一定条件下充分反应后得到的物质
B.铜绿受热完全分解后得到的黑色固体
C.将等物质的量的FeO与Fe2O3相混合后所得的固体物质
D.加热0.1mol的Cu(NO3)2晶体,将放出的气体通入足量的水后所得的溶液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市黄浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
|
温度(℃) |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com