
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(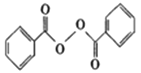 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
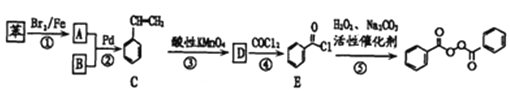
已知:![]()
请回答下列问题:
(1)工业上物质B主要来源于_____,物质D的名称是_______;每个C分子中最多有____个原子共平面。
(2)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是________。
(3)写出反应②的化学方程式________,反应类型为________。
(4)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有______种,请写出其中有三种不同化学环境的氢原子的结构简式:____________。
① 含有联苯(![]() )结构单元.无其他环状结构
)结构单元.无其他环状结构
② 在一定条件下能发生银镜反应
③ 1mol F最多可消耗4mol NaOH
(5)请写出以苯乙烯为原料,合成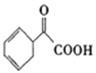 的流程,无机试剂任选,注明反应条件。____________
的流程,无机试剂任选,注明反应条件。____________
示例如下:![]()
【答案】 石油裂解(石油化工) 苯甲酸 16 分子中有过氧键,具有强氧化性 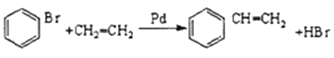 取代反应 12
取代反应 12 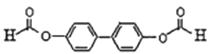
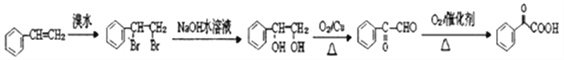
【解析】根据题中各物质的转化关系,结合信息提示,苯与Br/Fe发生取代反应生成A溴苯,溴苯与B发生取代反应生成苯乙烯,B为乙烯,苯乙烯被酸性高锰酸钾氧化生成D(苯甲酸),苯甲酸与COCl2发生取代反应生成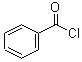 ,
, 与双氧水、碳酸钠在催化剂条件下生成
与双氧水、碳酸钠在催化剂条件下生成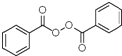 。
。
(1)工业上乙烯主要来源于石油裂解,物质D为苯甲酸;C为苯乙烯,苯乙烯分子中的苯环和碳碳双键都是平面结构,碳碳单键可以旋转,最多有16个原子共平面,故答案为:石油裂解;苯甲酸;16 ;
(2)过氧化苯甲酰分子中有过氧键,具有强氧化性,能够将有色物质氧化漂白,可以作为增白剂,故答案为:分子中有过氧键,具有强氧化性;
(3)反应②的化学反应方程式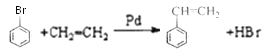 ,该反应属于取代反应,故答案为:
,该反应属于取代反应,故答案为: ;取代反应;
;取代反应;
(4)某物质F为过氧化苯甲酰( )的同分异构体,F的同分异构体符合下列条件;①含有联苯结构单元(
)的同分异构体,F的同分异构体符合下列条件;①含有联苯结构单元(![]() ),无其他环状结构;②在一定条件下能发生银镜反应,说明含有醛基;③1molF最多可消耗4molNaOH,说明酯基水解生成羧基和酚羟基,且含有2个甲酸酯基结构。满足条件的结构有:
),无其他环状结构;②在一定条件下能发生银镜反应,说明含有醛基;③1molF最多可消耗4molNaOH,说明酯基水解生成羧基和酚羟基,且含有2个甲酸酯基结构。满足条件的结构有:![]() (●为另一个甲酸酯基可能的位置)5种;
(●为另一个甲酸酯基可能的位置)5种;![]() 5种;
5种;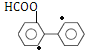 2种,共12种;其中有三种不同化学环境的氢原子的结构简式为
2种,共12种;其中有三种不同化学环境的氢原子的结构简式为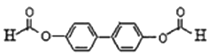 ,故答案为:12;
,故答案为:12; ;
;
(5)以苯乙烯为原料,合成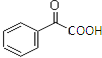 ,用逆推法可知,要生成羰基和羧基→羰基和醛基→2个羟基→2个卤原子→烯烃的溴代反应,
,用逆推法可知,要生成羰基和羧基→羰基和醛基→2个羟基→2个卤原子→烯烃的溴代反应,![]() ,所以合成路线为:
,所以合成路线为: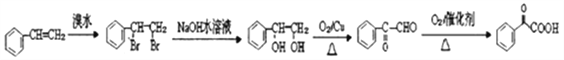 故答案为:
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
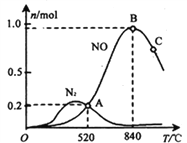
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键有如下所示的断裂方式:
 ;
;
 。
。
高分子单体A(C6H10O3)可进行如下反应(反应框图)

已知:
Ⅰ.对框图中某些化合物性质的说明:A在室温下不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na反应放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na反应放出H2。
Ⅱ.两个一OH连在同一个C原子上的结构不稳定。
(1)写出反应①中(1)的反应类型:___________;写出D的键线式:____________________。
(2)写出物质E所含官能团的名称: ____________________。
(3)B在浓H2SO4存在下与甲醇共热反应生成的有机物的系统名称为____________________。
(4)写出F→G的化学反应方程式:____________________________________。
(5)与B互为同分异构体,分子为链状的酯类物质共有______________种(不考虑立体异构)。
(6)请设计合理方案,用物质E制备乙二酸(其他原料自选,用反应流程图表示,并注明必要的反应条件) ______________。例如:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在右图所示的装置(代替量热计)中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
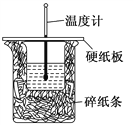
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)实验中改用 50mL 0.50 mol· L-1的醋酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。简述理由______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某核苷酸与核苷酸长链的示意图,据图回答问题:

(1)已知图甲的分子结构式右上角的含氮碱基为腺嘌呤(A)。请观察后回答下列问题:
图甲所示的核苷酸的名称是_________。该核苷酸是构成______的原料。
(2)图乙为一条核苷酸长链的片段,据图回答:
①图中所示1、2、3的名称分别是___、___、_____。4、5的名称分别是__、__。
②此结构中与另一种核酸相比较,其特有的碱基中文名称是_________。
(3)将水稻根细胞中的遗传物质彻底水解后,可得到
A.一种五碳糖B.四种脱氧核糖核苷酸C.5种含氮碱基D.8种核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
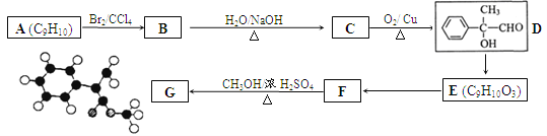
试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式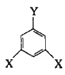 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学的发展离不开物质结构的探索和研究。物质结构研究对于保护生态环境、实现社会的可持续发展有重要的意义。请回答下列问题:
(1)基态铜原子最外层电子所占用能级的电子云轮廓图形状为_____,基态硒原子的价电子排布图为____。
(2)次氯酸分子的VSEPR模型名称为_______,中心原子的杂化类型为_________。
(3)C、O、F三者的第一电离能由小到大的顺序为___________。
(4)CaO的熔点比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3强,原因是_________。
(6)与CN-互为等电子体的离子有________(写出一种即可)。
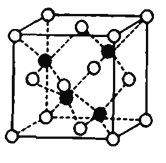
(7)Fe和S形成的某种晶胞如图所示:其中白球表示S,黑球表示Fe,则该物质的化学式为_______.该晶胞中硫原子的配位数为_______;假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为__________pm.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com