
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁离子能够氧化碘离子,不能共存;
B.二氧化碳少量,一水合氨优先反应;
C.硝酸根离子在酸性条件下能够氧化亚铁离子;
D.铝离子与氢氧根离子反应生成氢氧化铝沉淀.
解答 解:A.Fe3+、I-之间发生氧化还原反应,在溶液中不能共存,故A错误;
B.通入少量CO2,NH3•H20优先反应,正确的离子方程式为:2NH3•H20+C02═CO32-+H20+2NH4+,故B错误;
C.加入硝酸钡后,硝酸根离子在酸性条件下氧化亚铁离子,正确的离子方程式为:NO3-+3Fe2++4H+═NO↑+3Fe3++2H2O、SO42-+Ba2+═BaSO4↓,故C错误;
D.Al3+与少量氢氧化钙反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++30H-═Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写、离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:选择题
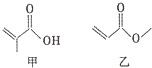
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 一定条件下,甲、乙均能发生取代反应 | |
| D. | 甲、乙都能与金属钠反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
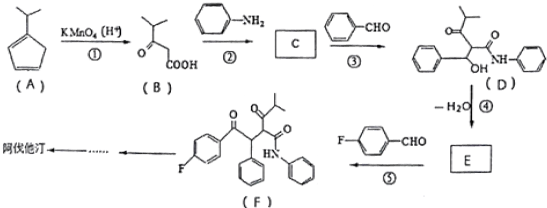
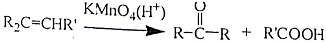 R、R′代表烃基)
R、R′代表烃基)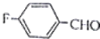 的名称对氟苯甲醛.
的名称对氟苯甲醛.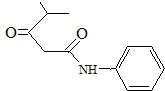 .
.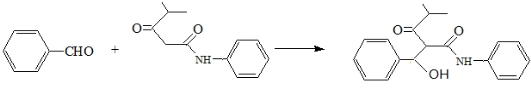 .
.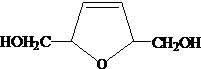 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
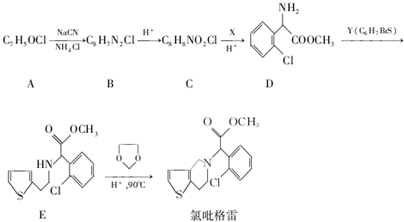
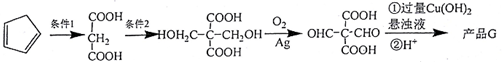
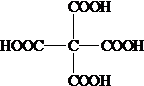
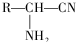 ,R-CN$\stackrel{H+}{→}$RCOOH
,R-CN$\stackrel{H+}{→}$RCOOH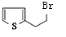 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.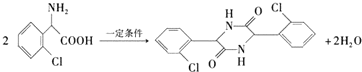 .
.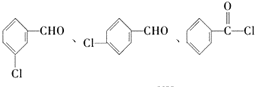 (不考虑立体异构).
(不考虑立体异构). 为有机原料制备化合物
为有机原料制备化合物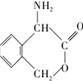 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).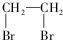 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
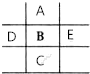 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )| A. | 铝 | B. | 镁 | C. | 磷 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)能自发进行,则该反应的△H<0 | |
| C. | 因NaCl溶液和CH3COONH4溶液均显中性,故两溶液中水的电离程度相同 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗,一定能证明CH3COOH是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com