
下列反应所得的有机产物只有一种的是
A.等体积的甲烷与氯气在光照条件下的取代反应
B.丙烯与氯化氢的加成反应
C.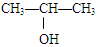 在浓硫酸作用下的消去反应
在浓硫酸作用下的消去反应
D.甲苯与液溴在溴化铁做催化剂条件下的取代反应
科目:高中化学 来源: 题型:阅读理解

| 名 称 | 相对分子质量 | 熔点或沸点(0C) | 水 | 醇 | 醚 |
| 水杨酸 | 138 | 158(熔点) | 微溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 | 可溶 | 易溶 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 | 可溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
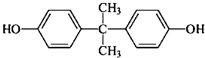 是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).
是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).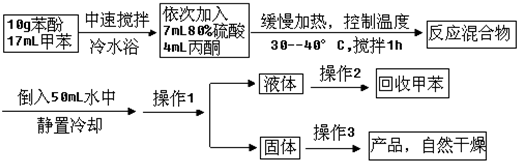
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州中学高二下学期期末考试化学试卷(带解析) 题型:实验题
(12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下: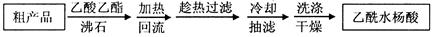
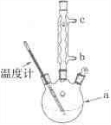
加热回流的装置如图所示: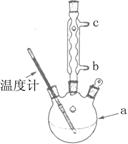
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第二次阶段性考试化学试卷(解析版) 题型:实验题
(10分) 阿司匹林(乙酰水杨酸,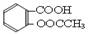 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:

主要试剂和产品的物理常数
|
名 称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
|
水杨酸 |
138 |
158(熔点) |
微溶 |
|
醋酸酐 |
102 |
139.4(沸点) |
反应 |
|
乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
⑴制备阿司匹林的化学方程式 。
⑵合成阿斯匹林时,如未出现结晶,可采取的措施有
_____________________________。
⑶提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
⑷另一种改进的提纯方法,称为重结晶提纯法。方法如下:
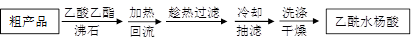 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示

①a仪器的名称 ,冷凝水的流出方向是 (填“b”或“c” )。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因是
_________________________________________________。
⑸检验产品中是否含有水杨酸的化学方法是 。
⑹该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m = 2.92g ,则所得乙酰水杨酸的产率为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省台州市高三调考试题(理综)化学部分 题型:填空题
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
一、制备K
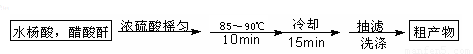 s*5u
s*5u
二、提纯
方案1
方案2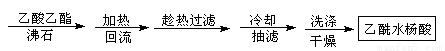
主要试剂和产品的物理常数
|
名 称 |
相对分子质量 |
熔点或沸点(0C) |
水 |
醇 |
醚 |
|
水杨酸 |
138 |
158(熔点) |
微溶 |
易溶 |
易溶 |
|
醋酸酐 |
102 |
139.4(沸点) |
反应 |
可溶 |
易溶 |
|
乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
可溶 |
微溶 |
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为 ▲ 溶液。
②本方案抽滤后进行洗涤,其具体操作是 ▲ 。
(2)方案2为改进的提纯方法,称为重结晶提纯法。
①该方案中步骤1除了选用乙酸乙酯外,还可选择下列哪些
试剂 ▲ 。
A. 乙醇 B. 蒸馏水 C. 乙醚
②步骤2回流的装置如图所示,写出仪器a的名称 ▲ ,使用温度计的目的是 ▲ ,冷凝水的流向为 ▲ 。

③方案2所得产品的有机杂质要比方案1少的原因是 ▲ 。
(3)该学习小组在实验中原料用量:2.0g水杨酸、5.0ml醋酸酐(ρ=1.08g·cm-3),
最终称量产品m=2.2g ,则乙酰水杨酸的产率为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com