
(6分)常温下,某水溶液M中存在的离子有:Na+、A一、H+、OH一。根据题意回答下列问题:
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”).
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”).
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2mL混合反应而得,则下列说法中正确的是 (填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH一)=2×10-7mol/L
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| c2(C) |
| c(A)×c3(B) |
| c2(C) |
| c(A)×c3(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
请回答
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
_______________________________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L________ , 混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+)(填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c(Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市天津一中高二上学期期末考试化学试卷 题型:填空题
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
 _____________________________________。
_____________________________________。查看答案和解析>>
科目:高中化学 来源:2013届天津市高二上学期期末考试化学试卷 题型:填空题
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合后溶液的pH |
|
甲 |
0.2 |
0.2 |
pH = a |
|
乙 |
C1 |
0.2 |
pH = 7 |
|
丙 |
0.2 |
0.1 |
pH >8 |
|
丁 |
0.1 |
0.1 |
pH = 9 |
请回答
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
_______________________________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2 mol/L________ , 混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+) (填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c (Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1) 铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
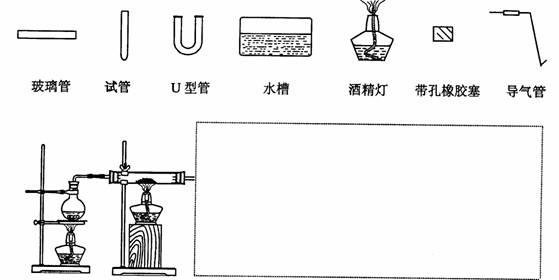
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含十3价的Fe元素。原因是(结合化学方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→叶红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的两种。
第一种:
第二种:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com