
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
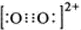 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3. 分析 (1)基态C原子核外有6个电子,根据构造原理书写其基态原子核外电子排布式;
(2)根据价层电子对互斥理论确定C原子杂化方式;
(3)C原子价层电子对个数是3且不含孤电子对,据此判断其空间构型;
(4)根据图1分析,Fe与N原子之间的键为配位键;
(5)利用均摊法计算以及电荷守恒来分析;
(6)等电子体结构和性质相似,根据C22-的结构书写O22+的电子式;利用均摊法计算出晶胞中含有CaC2的数目,再根据V=$\frac{m}{ρ}$计算;
解答 解:(1)基态C原子核外有6个电子,根据构造原理知C元素基态原子核外电子排布式为1s22s22p2,
故答案为:1s22s22p2;
(2)二氧化碳分子中C原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,
故答案为:sp;
(3)C原子价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,
故答案为:平面三角形;
(4)Fe与N原子之间的键为配位键,由图1可知,该配离子中Fe2+与氮原子形成配位键共有6个,
故答案为:6;
(5)Fe3+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$;Fe2+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$;CN一离子的个数为:12×$\frac{1}{4}$=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN一),得N(K+)=$\frac{1}{2}$,
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)=1:1:1:6,
故答案为:1:1:1:6;
(6)等电子体结构和性质相似,根据C22-的结构知O22+的电子式为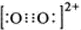 ;CaC2晶胞含有Ca2+数目为12×$\frac{1}{4}$+1=4,含有C22-的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则每个晶胞的质量为$\frac{4×64}{{N}_{A}}$g,晶胞的体积为V=$\frac{m}{ρ}$=$\frac{\frac{256}{{N}_{A}}}{{a}^{3}}$=$\frac{256}{a{N}_{A}}$cm3;
;CaC2晶胞含有Ca2+数目为12×$\frac{1}{4}$+1=4,含有C22-的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则每个晶胞的质量为$\frac{4×64}{{N}_{A}}$g,晶胞的体积为V=$\frac{m}{ρ}$=$\frac{\frac{256}{{N}_{A}}}{{a}^{3}}$=$\frac{256}{a{N}_{A}}$cm3;
故答案为: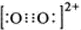 ;$\frac{256}{a{N}_{A}}$;
;$\frac{256}{a{N}_{A}}$;
点评 本题考查物质结构和性质,涉及晶胞计算、核外电子排布式的书写、微粒空间构型判断、等电子体等知识点,根据等电子体特点、晶胞、价层电子对互斥理论等知识点分析解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2体积不变 | B. | 剩余三分之一体积一氧化氮气体 | ||
| C. | 溶液充满集气瓶 | D. | 二氧化氮和一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | Zn具有氧化性和导电性,可用作锌锰干电池的负极材料 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 若一定条件下,A═B△H<0,说明A物质比B物质稳定 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+ (aq)+OH- (aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
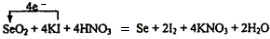 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
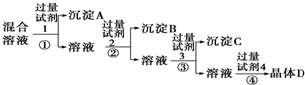
| A. | 硝酸银溶液 硝酸钡溶液 稀硝酸 | B. | 氯化钡溶液 稀硝酸 硝酸银溶液 | ||
| C. | 氢氧化钠溶液 硝酸银溶液 稀硝酸 | D. | 氯化钡溶液 硝酸银溶液 稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个过程中的还原剂只有I2 | |
| B. | CCl4层由紫色变成无色的化学反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl | |
| C. | 若用KI和Cl2反应制1molKIO3,至少需要56LCl2(标准状况) | |
| D. | 把 KI换成NBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HBrO3<Cl2<HIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com