
已知反应:C(s)+2H2(g) CH4(g)。在VL的容器中投入amol碳(足量),同时通入2am
CH4(g)。在VL的容器中投入amol碳(足量),同时通入2am ol H2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示。下列说法不正确的是( )
ol H2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示。下列说法不正确的是( )
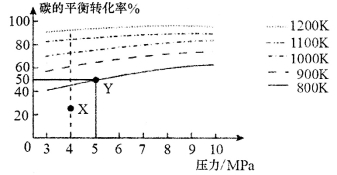
A.上述正反应为吸热反应
B.在4MPa、1200K时,图中X点v(H2)正>v(H2)逆
C .Y点H2的转化率为50%
.Y点H2的转化率为50%
D.工业上维持6MPa、1000K而不采用10MPa、1000K,主要是因为前者碳的转化率高
科目:高中化学 来源:2016-2017学年四川省高一11月月考化学卷(解析版) 题型:选择题
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z
由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.Z2可以置换出X2+溶液中的X
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:填空题
磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式 。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x= (用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag+ + □ = □PO4 3-+ □Ag +□
3-+ □Ag +□
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下
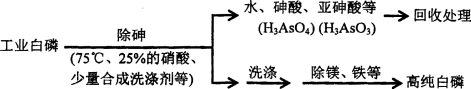
①除砷过程在75℃下进行,其合理的原因是_______(填字母)。
a.温度不宜过高,防止硝酸分解 b.适当提高温度,加快化学反应速率
c.使白磷熔化,并溶于水 d.降低白磷的毒性
②硝酸氧化除砷时被还原为NO,若氧化产物为等物质的量的亚砷酸与砷酸,则化学反应方程式为_______________
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向石灰水中逐渐通入过量CO2
②向Ca(ClO)2溶液中逐渐通入过量SO2
③向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
④向氯化钡溶液中逐渐通入过量二氧化硫
⑤向AgNO3溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳
A.①②⑥ B.①③⑤ C.②④⑥ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:填空题
工业合成氨:N2(g)+3H2(g) 2NH3(g) △H<0,氨又可以进一步制各硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) △H<0,氨又可以进一步制各硝酸,在工业上一般可进行连续生产。请回答下列问题:
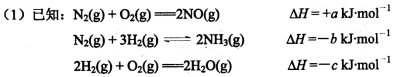
若有68g氨气经催化氧化完全生成NO(g)和H2O(g)所放出的热量为___________KJ。
(2)合成氨反应达到平衡后,某时刻改变下列选项中的__________条件,在达到新平衡的过程中逆反应速率始终增大。
a.升温 b.缩小容积 c.增大c(N2) d .使用催化剂
.使用催化剂
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成氨反应的影响。实验结果如下图所示:(图中T表示温度,横轴表示起始时H2的物质的量,纵轴表示平衡时NH3的体积分数)
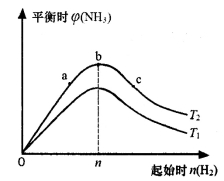
图像中T1和T2的关系是:T1____________T2 (填“>”“<”或“=”)。
比较在a、b、c三点所处的平衡状态中,反应物N 2的转化率最大的是_______________(填字母)。
2的转化率最大的是_______________(填字母)。
③若容器容积为1L,b点对应的起始时n(H2)=0.30mol,测得平衡时H2的转化率为60%,则平衡时c(N2)为_________________mo1·L-1。(已知反应物的物质的量按n(H2):n(N2)=3:1投料时,平衡时NH3的体积分数最大)
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同温度(T)、不同时间段内工业合成氨反应中N2的转化率,得到数据如下表所示:
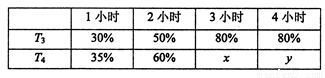
上表中x、y的大小关系为x_____________y。(填“>”“=”“<”“≥”或“≤” )
)
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
合成氨及其相关工业中,部分物质间的转化关系如下:
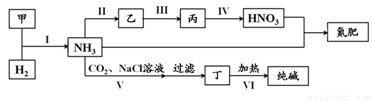
下列说法不正确的是( )
A.反应Ⅱ、III和Ⅳ的氧化剂一定相同
B.甲、乙、丙三种物质中都含有氮元素
C.反应Ⅵ的部分产物可在上述流程中循环利用
D. 反应V的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
反应V的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
化学 与生活息息相关。下列说法正确的是( )
与生活息息相关。下列说法正确的是( )
A.A12O3作耐火材料是因为氧化铝熔点高
B.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.石英、水晶、水泥、光导纤维等物质的主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
普伐他汀是—种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关 于普伐他汀的描述不正确的是
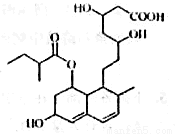
A.能使酸性KMnO4溶液褪色
B.能发生加成、取代、消去反应
C.其分子式为C23H35O7
D.1mol该物质最多可与2molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com