
科目:高中化学 来源: 题型:阅读理解

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解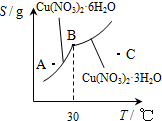
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明一中、二中高一上学期期末联考化学试卷(带解析) 题型:实验题
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、二中高一上学期期末联考化学试卷(解析版) 题型:实验题
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
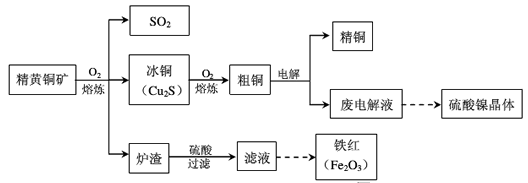
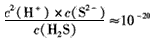 ,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。
,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com