

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
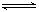 H����A2�����Իش��������⣺
H����A2�����Իش��������⣺| A��c(Na��)��c(K��)=c(HA��)��c(A2��) | B��ˮ�����ӻ�KW��c 2(OH��) 2(OH��) |
| C��V��10 | D��c(K��)��c(Na��) |
 ��֪������CaA��ˮ�д����ܽ�ƽ�⣻CaA(s)
��֪������CaA��ˮ�д����ܽ�ƽ�⣻CaA(s) 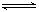 Ca2����A2������H��0��
Ca2����A2������H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ƣ�CH3COO��+ H2O �� CH3COOH + OH�� |
B���أ�S2��+ 2H2O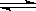 H2S +2 OH�� H2S +2 OH�� |
C���Ȼ�泥� NH4+ + H2O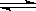 NH3��H2O + H+ NH3��H2O + H+ |
D����������Fe3+ +3 H2O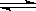 Fe(OH)3��+3 H+ Fe(OH)3��+3 H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(NH4��)��c(Cl��)��c(OH��)��c(H��) |
| B��c(Cl��)��c(NH4��)��c(H��)��c(OH��) |
| C��c(NH4��)��c(Cl��)��c(OH��)=c(H��) |
| D��c(Cl��)��c(NH4��)��c(OH��)��c(H��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�� H2O +H2O H3O+ +OH- H3O+ +OH- | B��HCO3- +OH- H2O +CO32- H2O +CO32- |
C�� CO2 +H2O H2CO3 H2CO3 | D��CO32- +H2O  HCO3- +OH- HCO3- +OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�� pH>7ʱ��c(C6H5O-)>c(K+)>c(H��)>c(OH�D) |
| B�� pH<7ʱ��c(K+)>c(C6H5O-)> c(H��)>c(OH�D) |
| C�� V [C6H5OH(aq)]=10mLʱ��c(K+)=c(C6H5O-)>c(OH�D)=c(H��) |
| D��V [C6H5OH(aq)]=20mLʱ��c(C6H5O-)+c(C6H5OH)=2c(K+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ˮ��ԭ���Ʊ����ײ��ϣ���д����TiCl4�Ʊ�TiO2��xH2O�Ļ�ѧ����ʽ�� ��
ˮ��ԭ���Ʊ����ײ��ϣ���д����TiCl4�Ʊ�TiO2��xH2O�Ļ�ѧ����ʽ�� ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com