
分析 卤代烃为有机物,依据相似相溶的理论可以判断其溶解性,卤原子的相对原子质量大于氢原子,所以取代氢原子生成的卤代烃相对分子质量大于对应的烃,卤代烃都是分子晶体,随着碳原子数的增多,相对分子质量增大,分子间作用力增强,沸点升高,以此解答该题.
解答 解:卤代烃为有机物都难溶于水,易溶于有机溶剂.卤原子的相对原子质量大于氢原子,所以取代氢原子生成的卤代烃的相对分子质量比相应烃的相对分子质量大,卤代烃都是分子晶体,随着碳原子数的增多,相对分子质量增大,分子间作用力增强,沸点升高,
故答案为:难;易;大;升高.
点评 本题考查了卤代烃的性质,为高频考点,侧重于学生的分析能力的课熬成,题目难度不大,了解卤代烃的机构及性质是解题的关键,注意卤代烃沸点高低的规律.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
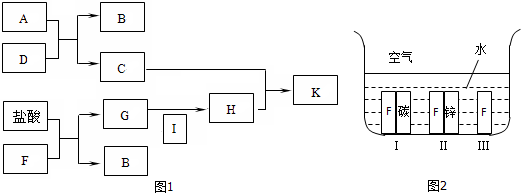
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| B. | 此时水的电离程度最大 | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为 $\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,钠长期暴露在空气中生成白色的氧化钠固体 | |
| B. | 铁能与氯气发生反应,故不能用铁制容器贮存氯气 | |
| C. | 铜能与氯化铁溶液发生置换反应,该反应可以用于印刷电路板的制作 | |
| D. | 燃着的镁条伸入盛满氮气的集气瓶中能继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
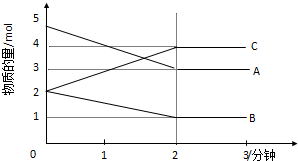
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
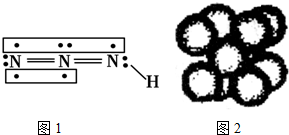
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时水的电离程度最大 | |
| B. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为$\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com