
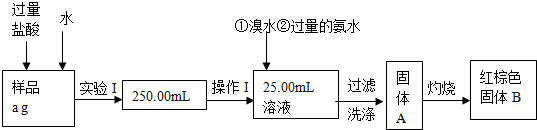

分析 (1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2)根据Br2具有氧化性,能氧化Fe2+写出反应的离子方程式;
(3)红棕色固体( Fe2O3)中的铁就是样品中铁,根据质量分数的公式求出铁元素的质量分数;
(4)①溶解样品若用盐酸,用高锰酸钾若用滴定时会氧化氯离子,影响实验测定结果;
②某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,加入铁做还原剂和过量的硫酸反应生成亚铁离子,会增加铁元素的量对测定结果产生误差;
③酸性条件下高锰酸根离子将亚铁离子氧化成铁离子,同时被还原生成锰离子;
④尖嘴部位有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定的铁元素的量偏高.
解答 解:(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还缺少250mL的容量瓶,
故答案为:250mL容量瓶;
(2)因Br2具有氧化性,能氧化Fe2+,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-,
故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)红棕色固体中的铁就是样品中铁,根据铁元素质量守恒,mgFe2O3中铁元素的质量为mg×$\frac{112}{160}$,则250mL配制的溶液中含有铁元素的质量为:mg×$\frac{112}{160}$×$\frac{250mL}{25mL}$=
7mg,
则样品中铁元素的质量分数是:$\frac{7mg}{ag}$×100%=$\frac{7m}{a}$×100%,
故答案为:$\frac{7m}{a}$×100%;
(4)①高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差,所以溶解样品不能用盐酸,应该用硫酸,
故答案为:盐酸中的Cl-对KMnO4溶液滴定有干扰;
②还原剂不能用铁,因为有贴分会和过量硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定,
故答案为:Fe与硫酸反应生成Fe2+影响铁元素质量分数的测定;
③酸性条件下用KMnO4滴定,亚铁离子被氧化成铁离子,反应的离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
④用滴定管装KMnO4溶液后如尖嘴部位有气泡,滴定后气泡消失,导致计算出消耗的酸性高锰酸钾溶液的体积偏大,所测得混合中Fe元素的物质的量偏大,则计算出的铁元素的含量偏大,
故答案为:偏大.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,明确实验目的及实验原理为解答关键,注意配制的溶液与实验中所取溶液体积关系,为易错点,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-3e一═Fe3+ | B. | Fe2+十20H-═Fe(OH)2 | ||
| C. | 2H20+02+4e-═40H- | D. | 4Fe(OH)2+2H20+02═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主要是用来吸收或滴加少量试剂,以及吸取上层清液,分离沉淀 | |
| B. | 进行滴加的时候,胶头滴管要保持垂直在容器正上方 | |
| C. | 取液体时,先将胶头滴管伸入试剂瓶中,用手指捏紧滴管的胶头再放开手指 | |
| D. | 专用的胶头滴管在使用完之后,就一定要放回原试剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质既能溶于盐酸,又能溶于NaOH溶液,则该物质一定是Al2O3 | |
| B. | 某气体只含C、H两种元素,且质量之比为6:1,则该气体一定为纯净物 | |
| C. | SO2通入品红溶液中,溶液褪色,则SO2通入紫色石蕊试液中,溶液也褪色 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com