
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
分析 0.2 mol•L-1的KHCO3溶液和0.1 mol•L-1的NaOH溶液,将两溶液等体积混合,得到浓度都0.05 mol•L-1的碳酸根离子、碳酸氢根离子和钠离子,而钾离子为0.1 mol•L-1,其中碳酸根离子的水解程度大于碳酸氢根离子的水解程度,由此分析解答.
解答 解:A、根据电荷守恒c(K+)+c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),而c(K+)=2c(Na+),所以3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确;
B、根据物料守恒,c(K+)=c(HCO3-)+c(CO32-)+c(H2CO3),又因为:c(K+)=2c(Na+),所以2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B错误;
C、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,水解溶液呈碱,c(HCO3-)+c(CO32-)=2c(Na+),所以c(K+)=2c(Na+)c(HCO3-)+c(CO32-)>c(Na+)>c(OH-)>c(H+),故C错误;
D、根据电荷守恒c(K+)+c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒,c(K+)=c(HCO3-)+c(CO32-)+c(H2CO3)②,将②代入①得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.05 mol•L-1,故D错误;
故选A.
点评 本题考查混合溶液中离子浓度大小的比较,首先应先让其反应,观察反应后的溶质,然后考虑电离和水解,在其过程中学生要注意守恒的巧妙应用,有一定的难度.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题

| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
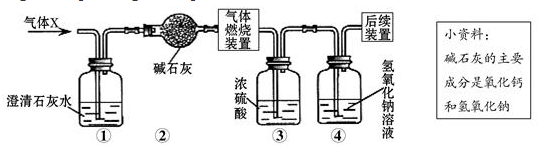
| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
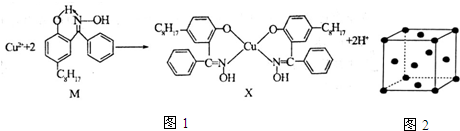
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
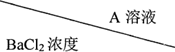 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增效应大于热效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com