
| A. | 产物H20所具有的总能量高于反应物H2和O2所具有的总能量 | |
| B. | 反应物H2所具有的能量高于产物H2O所具有的总能量 | |
| C. | 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 | |
| D. | 反应物H2和02具有的能量相等 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
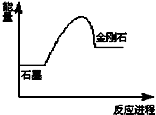
| A. | 该反应为放热反应 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨比金刚石稳定 | D. | 该反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y两元素形成的化合物可能存在共价键 | |
| B. | R的氢化物比Y的氢化物稳定 | |
| C. | Z、W、R最高价氯化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与R以两种元素组成的常见化合物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K与40Ca原子中的中子数相等 | |
| B. | 互为同位素的两种核素,它们原子核内的质子数一定相等 | |
| C. | 人们发现了112种元素,即共有112种核素 | |
| D. | 原子结构模型演变历史可以表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:
某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com