
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到化学平衡状态的标志是
2Z(g)达到化学平衡状态的标志是
A.Z的生成速率和X的分解速率相等
B.单位时间内生成nmolX,同时生成了3nmolY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子个数之比为1∶3∶2
科目:高中化学 来源: 题型:
【题目】化学小组在验证反应“![]() ”的实验中检测到Fe3+,发现和探究过程如下:
”的实验中检测到Fe3+,发现和探究过程如下:
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,静置片刻,烧杯底部有黑色固体,溶液呈黄色。
(1)探究反应产物
①取上层清液,滴入酸性高锰酸钾溶液中,溶液紫色褪去,说明溶液中含有的离子是________(写化学式)。
②取少量黑色固体,洗涤后,加稀硝酸溶解固体,再加盐酸,观察到________,证明黑色固体中含有Ag。
(2)对“溶液呈黄色”进行探究
①甲认为溶液中有Fe3+;乙认为铁粉过量时不可能有Fe3+,乙的理由是________(用离子方程式表示)。
②对Fe3+产生的原因作出如下假设:
假设Ⅰ:空气中的O2将Fe2+氧化;
假设Ⅱ:酸性溶液中![]() 具有氧化性,将Fe2+氧化;
具有氧化性,将Fe2+氧化;
假设Ⅲ:溶液中的________将Fe2+氧化。
③实验验证:
ⅰ.向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,取不同时间的上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后,溶液几乎无色。
ⅱ.向ⅰ中所得上层清液中加入________溶液,有黑色固体析出,向上层清液中滴加KSCN溶液,溶液变红。
④综合上述实验得知,假设________(填序号)正确,氧化Fe2+的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为探究硫酸铜晶体(CuSO4·xH2O)受热分解后所得产物,设计实验装置如图所示,部分实验现象为:A中蓝色晶体逐渐变成白色粉末,继续加热最终变成黑色;B中产生白色沉淀;D中溶液变成红色。(洗气瓶中试剂均足量)
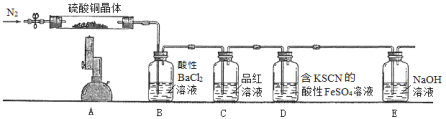
(1)分析推测该硫酸铜晶体最终分解产物可能有_______________________________。
(2)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
II.测定硫酸铜晶体(CuSO4·xH2O)中结晶水x的值,实验装置和过程如下:取硫酸铜晶体7.23 g置于硬质试管中,先通N2排除体系内空气,酒精喷灯高温加热充分,待A中蓝色晶体最终变成黑色,停止加热,再次鼓入N2至装置冷却到室温。(洗气瓶中试剂均足量)
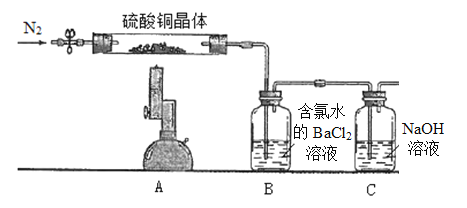
(1)取B中白色沉淀经过滤洗涤干燥称量得固体6.99 g,经计算可得CuSO4·xH2O中x=__________,再次鼓入N2的目的是____________________。
(2)某同学提出,要测定晶体中结晶水x的值,也可将B装置用装有浓硫酸的洗气瓶替换,最终测浓硫酸增重即可计算得到结果,评价该同学的方案是否可行?(如果不可行,请说明理由)_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
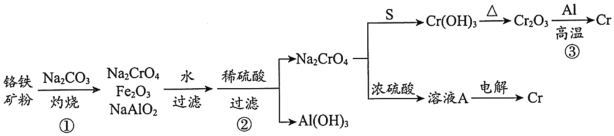
A.①中需持续吹入空气作氧化剂B.②中需加入过量稀硫酸
C.③中发生了置换反应D.溶液A为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的____________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是____________(填物质名称)。
②对比实验a、b可以得到的结论有____________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于____________(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在12g某二价金属的硫酸盐中,含有0 4mol氧原子,此硫酸盐的摩尔质量为_________g/mol。
(2)质量分数为49%的硫酸溶液,密度为1.8g/cm3,则物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。
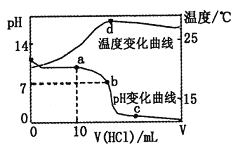
下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com