
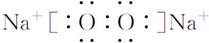 .
.分析 由A(固体)$\stackrel{加热}{→}$B+C+D,A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,综合分析得出:A是NaHCO3,B是Na2CO3,根据C+E→B+G,D+E→F+G可知,C是CO2,D 是H2O,E是Na2O2,F是NaOH,G是O2,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,碳酸钠、二氧化碳、水反应生成碳酸氢钠,符合题中各物质转化关系,据此答题.
解答 解:由A(固体)$\stackrel{加热}{→}$B+C+D,A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,综合分析得出:A是NaHCO3,B是Na2CO3,根据C+E→B+G,D+E→F+G可知,C是CO2,D 是H2O,E是Na2O2,F是NaOH,G是O2,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,碳酸钠、二氧化碳、水反应生成碳酸氢钠,符合题中各物质转化关系,
(1)A是NaHCO3,A的俗名 是小苏打,C是CO2,C的结构式为O=C=O,E是Na2O2,E的电子式为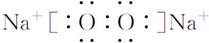 ,
,
故答案为:小苏打;O=C=O;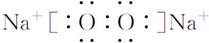 ;
;
(2)反应④为碳酸氢钠与氢氧化钠反应生成碳酸钠和水,反应的离子方程式为HCO3-+OH-═CO32-+H2O,反应⑤为碳酸钠、二氧化碳、水反应生成碳酸氢钠,反应的离子方程式为CO32-+CO2+H2O═2HCO3-,
故答案为:HCO3-+OH-═CO32-+H2O;CO32-+CO2+H2O═2HCO3-;
(3)B是Na2CO3,向盛有约1g的B的固体试管中滴入几滴水,振荡观察现象为 白色粉末变成白色晶体,且试管底部变热,
故答案为:白色粉末变成白色晶体,且试管底部变热;
(4)A是NaHCO3,B是Na2CO3,碳酸钠水解程度大于碳酸氢钠,所以等物质的量浓度的A和B的稀溶液的pH值A<B,
故答案为:<;
(5)E是Na2O2,在Na2O2与二氧化碳反应中当有1 mol Na2O2发生反应时电子转移的个数是NA,
故答案为:NA.
点评 本题考查钠及其化合物的相互转化关系,难度中等,结合转化关系进行推断,对学生的逻辑推理能力提出较高的要求,解决问题的关键是熟记常见元素化合物知识.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:推断题
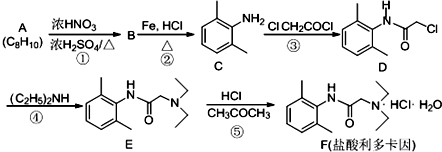
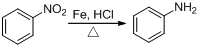
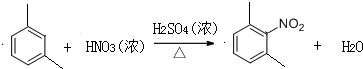 ,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号).
,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号). (R为烃基)
(R为烃基)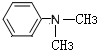 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
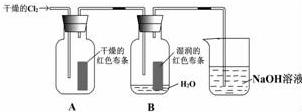 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
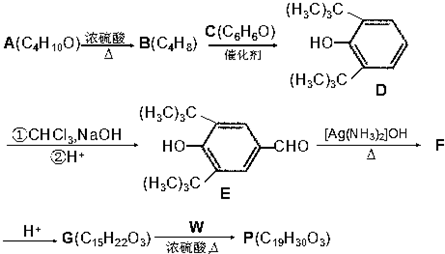
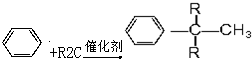 (R为烷基)
(R为烷基)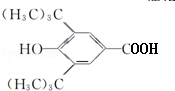 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;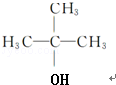 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;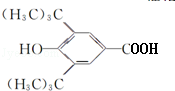 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$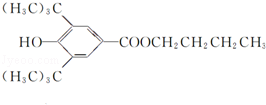 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com