
X、Y、Z、W为四种短周期主族元素,原子序数依次增大。其中X、Z同主族,Y、Z同周期,Y原子的最外层电子数是次外层电子数的一半,X原子的最外层电子数是核外电子层数的3倍,W的最高正化合价与最低负化合价的代数之和为6。下列说法正确的是( )
A.X、Y、Z、W四种元素的简单氢化物中,W的氢化物的沸点最高
B.X、Y、Z三种元素的原子半径由大到小的顺序为Y>X>Z
C.Y、Z、W三种元素的非金属性由强到弱的顺序为W>Z>Y
D.Y、Z、W三种元素的最高价氧化物对应的水化物都是强酸
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.放热反应在常温下一定容易进行
B.植物的光合作用是把太阳能转化为热能的过程
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的
D.凡是在加热或点燃条件下进行的反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化硫的催化氧化的过程如图所示:
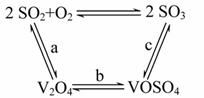
其中a、c二步的化学方程式可表示为____________
SO2+V2O5 SO3+V2O4
SO3+V2O4
4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
该反应的催化剂是__________(写化学式)。
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关 系如图所示:
系如图所示:
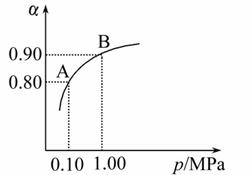
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。
2SO2+O2 在550 ℃时的平衡常数K=_________。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0 mol SO2和1.0 mol O2
(4)维持温度不变条件下使之发生如下反应:
2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:

试填写下列空格:
A容器达到平衡时所需的时间比B容器___________(填“短”或“长”);平衡时A容器中SO2的转化率 比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是_______________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)___________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
_____________。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
B项中和反应本身是放热反应,C项是因为NH4NO3溶于水吸热,D项是因为NH4Cl抑制NH3·H2O 的电离而使pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法不正确的是( )
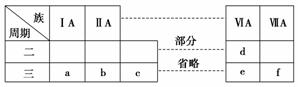
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:e>d>a>b
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z的原子序数之和为40,最外层电子数之和为10,下列说法正确的是( )
A.Y的最高价氧化物对应的水化物一定是强碱
B.Z一定位于ⅦA族
C.若X、Y、W形成的化合物为XYW2,则其水溶液显碱性
D.X与足量的W反应生成的化合物为X2W
查看答案和解析>>
科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1。
则LiH在O2中燃烧的热化学方程式为( )
A.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1
B.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-1 950 kJ·mol-1
C.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-1 586 kJ·mol-1
D.2LiH(s)+O2(g)===Li2O(s)+H2O(g) ΔH=-988 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com