
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.50g34%H2O2溶液中含H-O键的数目为NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )

A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示A~F六种仪器:

(1)C是___(用仪器名称填空,下同),D是___,能用酒精灯加热的是___。
(2)下列实验操作中用到仪器E的是___(选填下列选项的编号字母)。
a.分离水和CC14的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制一定物质的量浓度的盐酸,需用密度为1.25g mL-1、 37%的浓盐酸4.5mL。
①取用4.5mL盐酸时,需要用到上述仪器中的F和___(选填仪器的编号字母)。
②取用4.5mL盐酸,利用D(250mL)等仪器配制一定物质的量浓度的盐酸,正确操作配得的盐酸物质的量浓度为___mol/L(保留2位有效数字)。
③下列情况中,会使所配溶液浓度偏高的是___(填序号)。
A.量取所需盐酸观察液面时仰视 B.容量瓶内有少量蒸馏水
C.加蒸馏水时,不慎超过了刻度线 D.定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家合成的铬的化合物,通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现岀较好的催化活性。合成铭的化合物过程中一步反应如下,该反应涉及H、C、N、O、Cl、Cr等多种元素。
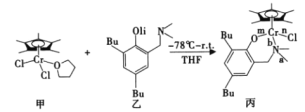
回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是_____________(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)化合物乙中碳原子采取的杂化方式为______,化合物丙中a、b、n、m处的化学键是配位键的是______(填字母)处。
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为______;已知没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子为无颜色的是______(填离子符号)。
(4)ClO3-的键角小于ClO4-的键角,原因是______。
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:______。
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为_____晶胞边长为a pm,则重冰的密度为 ____g·cm-3(写出数学表达式,NA为阿伏伽徳罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
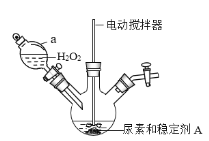
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com