
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
分析 A.具有强氧化性的物质都能够使品红溶液褪色,如氯气也能使品红褪色;
B.二氧化硫也能够与澄清石灰水反应生成白色沉淀;
C.浓硝酸也具有挥发性,可能为浓硝酸;
D.能够与硫氰化钾反应生成血红色的离子一定为铁离子.
解答 解:A.将某气体通入品红溶液中,品红褪色,气体可能为二氧化硫,也可能为氯气等,故A错误;
B.能够使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,所以该气体可能为二氧化硫,不一定为二氧化碳,故B错误;
C.挥发性酸与浓氨水反应生成盐,冒白烟,则溶液可能是浓盐酸或浓硝酸,不等于为浓盐酸,故C错误;
D.与硫氰化钾溶液反应呈血红色的离子一定为铁离子,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,题目难度中等,涉及漂白性、浓盐酸和浓硝酸的挥发性及铁离子检验等知识,注重实验原理及物质性质的考查,注意实验的操作性、评价性分析,明确常见物质的性质及检验方法为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 漂白粉溶液中加入醋酸:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
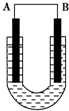 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
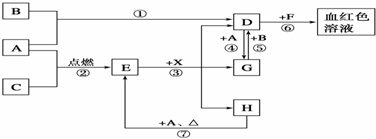
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
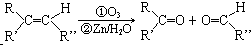

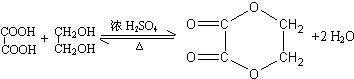 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、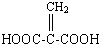 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
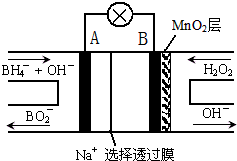 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 电极B为正极,纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从正极区向负极区迁移 | |
| C. | 电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com