
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗下口放出碘的苯溶液 | |
| D. | 常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA |
分析 A.pH试纸测定的pH为整数而没有小数;
B.酸碱中和滴定实验中锥形瓶不能用待测液润洗;
C.分液时,下层液体从下口倒出,为防止含有杂质,上层液体从上口倒出;
D.常温常压下,气体摩尔体积大于22.4L/mol,n(NO)=$\frac{15g}{30g/mol}$=0.5mol,n(O2)=$\frac{8g}{32g/mol}$=0.25mol,二者恰好反应生成二氧化氮0.5mol,但二氧化氮能自身转化为四氧化二氮.
解答 解:A.pH试纸测定的pH为整数而没有小数,所以广泛pH试纸不可能测得 0.1mol/L NH4Cl溶液的pH=5.2,故A错误;
B.酸碱中和滴定实验中锥形瓶不能用待测液润洗,否则会导致待测液物质的量增大,导致测定结果偏大,故B错误;
C.分液时,下层液体从下口倒出,为防止含有杂质,上层液体从上口倒出,苯密度小于水,所以与苯与碘水混合时苯位于上方,应该从分液漏斗上口倒出,故C错误;
D.常温常压下,气体摩尔体积大于22.4L/mol,n(NO)=$\frac{15g}{30g/mol}$=0.5mol,n(O2)=$\frac{8g}{32g/mol}$=0.25mol,二者恰好反应生成二氧化氮0.5mol,但二氧化氮能自身转化为四氧化二氮,所以导致气体总物质的量小于0.5mol,则分子数小于0.5NA,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及基本物质分离和提纯、误差分析、pH测定、可逆反应等知识点,明确实验基本操作方法、物质的性质是解本题关键,易错选项是D,很多同学往往忘记二氧化氮和四氧化二氮之间的转化而导致错误,题目难度不大.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=3:8时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ②⑤ | C. | ③⑤⑥ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
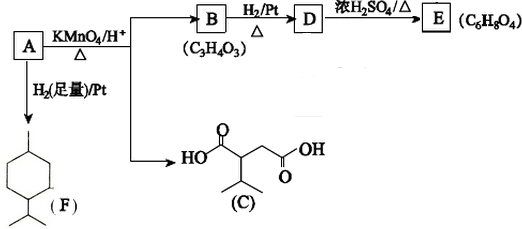
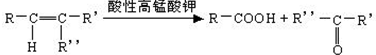
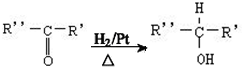
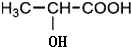 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$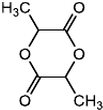 +2H2O.
+2H2O. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含Ag+ |
| B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO32- |
| C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl- |
| D | ①加KSCN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中肼作还原剂 | |
| B. | 液态肼的燃烧热△H为-641.6kJ•mol-1 | |
| C. | 该动力源的突出优点之一是生成物对环境污染小 | |
| D. | 肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com